Metal de transição
há um número de propriedades compartilhadas pelos elementos de transição que não são encontrados em outros elementos, o que resulta da Concha D parcialmente preenchida. Estes incluem
- a formação de compostos cuja cor é devida a d–d eletrônicos transições
- a formação de compostos em vários estados de oxidação, devido à relativamente baixa energia de gap entre diferentes estados de oxidação
- a formação de muitos compostos paramagnéticos devido à presença de desemparelhados d elétrons. A few compounds of main group elements are also paramagnetic (e.g. óxido nítrico, oxigênio)
a maioria dos metais de transição pode ser ligada a uma variedade de ligantes, permitindo uma grande variedade de complexos metálicos de transição.
compostos Coloridos

3)
2 (vermelho); K
falhas 2cr
2
7 (laranja); K
2CrO
4 (amarelo); NiCl
2 (azul turquesa); CuSO
4 (azul); KMnO
4 (roxo).a cor dos compostos metálicos das séries de transição deve-se geralmente a transições electrónicas de dois tipos principais.transições de transferência de encargos. Um elétron pode saltar de um ligando orbital predominantemente para um orbital predominantemente metal, dando origem a uma transição ligando-a-metal de transferência de carga (LMCT). Estes podem ocorrer mais facilmente quando o metal está em um estado de oxidação elevado. Por exemplo, a cor dos iões cromato, dicromato e permanganato é devida às transições LMCT. Outro exemplo é que o iodeto mercúrico, HgI2, é vermelho por causa de uma transição LMCT.
uma transição de carga metal-ligando (MLCT) será mais provável quando o metal está em um estado de baixa oxidação e o ligante é facilmente reduzido.
em geral, transições de transferência de carga resultam em cores mais intensas do que transições d-D.transições d-D. Um elétron salta de um orbital d para outro. Em complexos dos metais de transição, os orbitais d não têm todos a mesma energia. O padrão de divisão dos orbitais d pode ser calculado usando a teoria do campo de cristal. A extensão da divisão depende do metal em particular, seu estado de oxidação e a natureza dos ligantes. Os níveis reais de energia são mostrados nos diagramas de Tanabe-Sugano.
em complexos centrosimétricos, tais como complexos octaedrais, transições d-d são proibidas pela regra de Laporte e só ocorrem por causa de acoplamento vibrônico no qual uma vibração molecular ocorre juntamente com uma transição d-D. Complexos tetraédricos têm uma cor um pouco mais intensa porque misturar orbitais d e p é possível quando não há Centro de simetria, então transições não são transições puras d-D. A absorvividade molar (ε) das bandas causadas por transições d-d é relativamente baixa, aproximadamente na faixa de 5-500 M−1cm−1 (em que M = mol dm−3). Algumas transições d – d são proibidas. Um exemplo ocorre em complexos octaédricos de alto spin de manganês(II), que tem uma configuração d5 na qual todos os cinco elétrons têm spins paralelos; a cor de tais complexos é muito mais fraca do que em complexos com transições de spin-permitidas. Muitos compostos de manganês (II) parecem quase incolores. O espectro de 2+mostra uma absorvividade molar máxima de cerca de 0,04 M-1cm – 1 no espectro visível.uma característica dos metais de transição é que eles apresentam dois ou mais estados de oxidação, geralmente diferentes por um. Por exemplo, os compostos de vanádio são conhecidos em todos os estados de oxidação -1, tais como: −
e +5, como VO3−
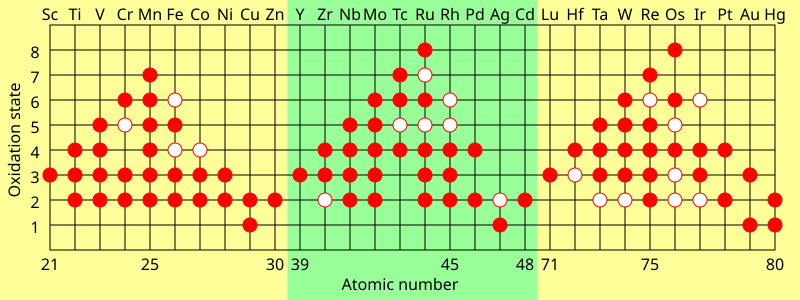
elementos do grupo principal nos grupos 13 a 18 também apresentam estados de oxidação múltiplos. Os estados de oxidação” comuns ” destes elementos diferem tipicamente por dois em vez de um. Por exemplo, compostos de gálio em estados de oxidação +1 e +3 existem em que existe um único átomo de gálio. Nenhum composto de Ga (II) é conhecido: Qualquer composto teria um elétron não emparelhado e se comportaria como um radical livre e seria destruído rapidamente. Os únicos compostos em que o gálio tem um estado de oxidação formal de +2 são compostos diméricos, tais como 2−
, que contêm uma ligação Ga-Ga formada a partir do elétron não emparelhado em cada átomo de Ga. Assim, a principal diferença nos estados de oxidação, entre elementos de transição e outros elementos é que os estados de oxidação são conhecidos em que há um único átomo do elemento e um ou mais elétrons não emparelhados.
O Estado de oxidação máximo nos metais de transição da primeira linha é igual ao número de elétrons de valência de titânio (+4) até manganês (+7), mas diminui nos elementos posteriores. Na segunda linha, o máximo ocorre com rutênio (+8), e na terceira linha, o máximo ocorre com irídio (+9). In compounds such as –
and OsO
4, the elements achieve a stable configuration by covalent bonding.
os estados de oxidação mais baixos são exibidos em complexos carbonílicos metálicos tais como Cr(CO)
6 (estado de oxidação zero) e 2−
(estado de oxidação -2) em que a regra dos 18 elétrons é obedecida. Estes complexos também são covalentes.compostos iónicos são formados principalmente com estados de oxidação +2 e + 3. Em solução aquosa, os íons são hidratados (geralmente) por seis moléculas de água dispostas octaedralmente.os compostos de metais de transição são paramagnéticos quando têm um ou mais electrões d não emparelhados. Nos complexos octaédricos com entre quatro e sete elétrons d, Tanto o spin elevado quanto o spin baixo são possíveis. Complexos metálicos de transição tetraédricos, como 2-
são de alta rotação porque a divisão do campo de cristal é pequena de modo que a energia a ser obtida em virtude dos elétrons estarem em orbitais de menor energia é sempre menor do que a energia necessária para emparelhar as voltas. Alguns compostos são diamagnéticos. Estes incluem complexos octaédricos, low-spin, d6 e square-planar d8. Nestes casos, a separação do campo de cristal é tal que todos os elétrons são emparelhados.o ferromagnetismo ocorre quando átomos individuais são paramagnéticos e os vetores de spin são alinhados paralelos uns aos outros em um material cristalino. O ferro metálico e a liga alnico são exemplos de materiais ferromagnéticos envolvendo metais de transição. O anti-ferromagnetismo é outro exemplo de uma propriedade magnética decorrente de um alinhamento particular de voltas individuais no estado sólido.os metais de transição e seus compostos são conhecidos por sua atividade catalítica homogênea e heterogênea. Esta atividade é atribuída à sua capacidade de adotar múltiplos estados de oxidação e de formar complexos. Óxido de vanádio (V) (no processo de contato), ferro finamente dividido (no processo de Haber), e níquel (na hidrogenação catalítica) são alguns dos exemplos. Catalisadores em uma superfície sólida (catalisadores baseados em nanomaterial) envolvem a formação de ligações entre moléculas reagentes e átomos da superfície do catalisador (metais de transição de primeira linha utilizam elétrons 3d e 4s para ligação). Isto tem o efeito de aumentar a concentração dos reagentes na superfície do catalisador e também enfraquecer as ligações nas moléculas reagentes (a energia de ativação é baixada). Também porque os iões metálicos de transição podem mudar os seus estados de oxidação, tornam-se mais eficazes como catalisadores.
Um tipo interessante de catálise ocorre quando os produtos de uma reação catalisam a reação produzindo mais catalisador (autocatálise). Um exemplo é a reação do ácido oxálico com permanganato de potássio acidificado (ou manganato (VII)). Uma vez que um pouco Mn2+ foi produzido, ele pode reagir com MnO4 formando Mn3+. This then reacts with C2O4-ions forming Mn2+ again.
propriedades físicas
como implícito pelo nome, todos os metais de transição são metais e, portanto, condutores de eletricidade.em geral, os metais de transição possuem uma alta densidade e pontos de fusão e de ebulição elevados. Estas propriedades são devidas à ligação metálica por elétrons d deslocalizados, levando à coesão que aumenta com o número de elétrons compartilhados. No entanto, os metais do grupo 12 têm pontos de fusão e ebulição muito mais baixos, uma vez que suas sub-conchas d impedem a ligação d–d, que novamente tende a diferenciá-los dos metais de transição aceites. Mercúrio tem um ponto de fusão de -38,83 °c (-37,89 °F) E é um líquido à temperatura ambiente.
Leave a Reply