hidróxido de Sódio
hidróxido de Sódio Química,Propriedades,Usos, Produção
Propriedades Químicas
hidróxido de Sódio é um branco, inodoro, não-volátil alcalina material comercializado na forma sólida, como pelotas, em flocos, grumos, ou paus. Sua solubilidade em água é de 111% em peso e uma pressão de vapor de 0mmHg (NIOSH, 1994).pode reagir com tricholoetileno (TCE) para formar dicloroacetileno inflamável e com metais para formar gás hidrogênio (OEHHA, 1993). A sua reactividade com os metais deve ser considerada no que respeita às unidades de armazenagem e aos contentores.
hidróxido de Sódio é normalmente disponível como uma solução aquosa conhecida como soda cáustica, soda cáustica, ou simples, como a soda cáustica. Tem vários usos, incluindo a neutralização do ácido; a fabricação de papel, têxteis, plásticos, corrosivos, corantes, tinta, removedor de tinta e sabão; refino de petróleo; galvanoplastia; Lavagem de metal; lavagem e lavagem de pratos. Um consumo crescente tem estado na produção ilegal de metanfetaminas. o hidróxido de sódio (NaOH) é um dos compostos de sódio industriais mais úteis. É também conhecida como lixívia de soda cáustica e é uma das bases mais fortes de alcalis (alto valor de pH)no mercado doméstico. É utilizado como Desentupidor e limpador de fornos, e saponifica gorduras na automutura de sabão. Deve ser utilizado com cuidado, pois também é capaz de produzir queimaduras de serigrafia.
descrição
hidróxido de sódio, também conhecido como lixívia e soda cáustica, é uma substância altamente cáustica que é usada em pequenas quantidades em cosméticos para estabelecer e manter o pH de um produto.Hidróxido de sódio é um composto extremamente importante em nossas vidas porque tem tantos usos. É uma base muito comum utilizada na indústria química e é utilizada para muitas coisas, muitas das quais ocorrem na nossa vida diária. Um dos usos mais conhecidos do hidróxido de sódio é o seu uso em drenagens. Ele vem em muitas marcas diferentes de limpadores de dreno, mas um dos mais comuns é Drano. Ele também vem na forma de sabão de lixívia, que pode ser usado para lavar praticamente qualquer coisa, a partir dos pratos para o seu rosto.
estrutura de hidróxido de sódio
à temperatura ambiente, hidróxido de sódio é um sólido branco cristalino e inodoro que absorve a umidade do ar. É uma substância fabricada. Hidróxido de sódio é um composto inorgânico usado para controlar os níveis de pH ou servir como agente tampão em cosméticos e produtos de cuidados pessoais. Ele foi historicamente utilizado na formulação de sabonetes, mas atualmente é visto em uma variedade de fórmulas, incluindo produtos de banho, produtos de limpeza, perfumes, pé de pós, tinturas de cabelo e cores, maquiagem, unhas, produtos de higiene pessoal produtos, shampoos, produtos para barbear, depilatórios, produtos de cuidados da pele e bronzeador produtos, bem como as químicas alisantes de cabelo e cabelo de onda define. É também um ingrediente popular em solventes industriais como base química para sabonetes, limpadores de fornos, detergentes e limpadores de drenagem devido à sua capacidade de dissolver gorduras, óleos, gorduras e depósitos à base de proteínas, de acordo com a Wikipédia. Menos frequentemente, o hidróxido de sódio é visto como um ingrediente em pastas dentífricas.
Hidróxido De Sódio é aprovado pela FDA, e recebeu a classificação de GRAS (geralmente reconhecido como Seguro) como um aditivo alimentar direto. No entanto, é usado principalmente na lavagem e descamação química dos produtos. Ele é aprovado para uso em cosméticos e produtos de cuidados pessoais em diferentes concentrações: 5%, em peso na unha com cutícula solventes, 2%, em peso, de alisadores de cabelo para uso geral, de 4,5%, em peso, de alisadores de cabelo para uso profissional, até um pH de 12,7 em depilatórios, e até pH 11 em outras utilizações como regulador de pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Propriedades Químicas
hidróxido de Sódio, NaOH,também conhecido como soda cáustica ou hidrato de sódio(e anteriormente conhecido como soda cáustica), é um branco,enorme, deliquescente, produto sólido cristalino, que é solúvel em água,álcool e glicerina. Derrete a 318 ° c (606 de) e é o Químico Alcalino mais utilizado e disponível. A maioria do hidróxido de sódio é produzido como um coproduto de cloro através do uso de células eletrolíticas;as células são do diafragma, mercúrio, ou tipo de membrana. Um pouco de hidróxido de sódio é marcado como produzido nas células;a maior parte é evaporada e vendida como 50% e 73% de soluções ou como esferas anidras. A maioria das utilizações finais cáusticas requerem soluções de concentrações relativamente baixas. A soda cáustica é utilizada como reagente analítico e como produto químico intermédio, em banhos de lavagem e limpeza,em recuperação de borracha e refinação de petróleo, em banhos de extinção para tratamento térmico do aço,em corte e óleos solúveis,em sabões e detergentes e numa grande variedade de outras aplicações.
propriedades químicas
NaOH é um material branco, inodoro e deliquescente vendido como pellets, flocos, grumos ou paus. Soluções aquosas são conhecidas como lixívia de soda
propriedades químicas
hidróxido de sódio ocorre como uma massa fundida branca ou quase branca. Encontra-se disponível em pequenas pellets, flocos, paus e outras formas ou formas. É duro e frágil e apresenta uma fractura cristalina. O sodiumhidroxide é muito deliquescente e, ao ser exposto ao ar, absorve rapidamente o dióxido de carbono e a água.
propriedades Físicas
Branco orthorhombic cristais, produzido na forma de grânulos, caroços), varas, grânulos, aparas, lascas ou soluções; higroscópico; muito corrosivo; rapidamente absorve o CO2 e a água do ar; densidade de 2,13 g/cm3; derrete em 323°C; vaporiza em 1388°C; pressão de vapor de 1 torr em 739°C e 5 torr em 843°C; muito solúvel em água (110 g/100 ml) à temperatura ambiente), a geração de calor em caso de dissolução; soluções aquosas altamente alcalina, com pH de 0,5% de solução de cerca de 13 e 0,05% de solução de cerca de 12; solúvel em metanol, etanol e glicerol (de 23,8 g/100 mL de metanol e 13.9 g / 100 mL de etanol à temperatura ambiente.).
usa
A soda cáustica é uma das substâncias químicas mais utilizadas. É utilizado para neutralizar ácidos; tomar sais de sódio; precipitar metais como seus hidróxidos; na refinação de petróleo; naaponificação de ésteres; no tratamento da celulose, Plásticos e borracha; e em numeroussintéticas e analíticas aplicações. o hidróxido de sódio é vendido comercialmente sob a forma de flocos ou pellets anidros ou sob a forma de soluções aquosas a 50% ou 73%. Tem inúmeros usos industriais e é um dos 10 melhores químicos em termos de produção e uso em escala global. Aproximadamente 15 milhões de toneladas de hidróxido de sódio são usadas anualmente. Seu maior uso, consumindo cerca de metade de sua produção, é como base na produção de outros produtos químicos. É usado para controlar o pH e neutralizar ácidos em processos químicos. A indústria de papel faz uso extensivo de hidóxido de sódio no processo de polpagem. Hidróxido de sódio é usado para separar fibras dissolvendo a lignina de ligação. É usado de forma semelhante na produção de rayon a partir de celulose. Hidróxido de sódio é um químico chave no sabão industry.In o processo de saponificação, triglicéridos obtidos a partir de animais e plantas são aquecidos em solução abásica para dar glicerol e sabão:
hidróxido de sódio é usado na indústria têxtil para branqueamento e tratamento de têxteis para tornar o corante mais facilmente. A indústria petrolífera utiliza hidróxido de sódio em Lamas de perfuração e bactericida asa. O hipoclorito de sódio (NaOCl) é amplamente utilizado na limpeza e como desinfectante.A lixívia doméstica comum consiste em cerca de 5% de solução de hipoclorito de sódio. Sodiumhypochlorite is prepared by reacting chlorine with sodium hydroxide: Cl2(g) + 2NaOH(aq) →NaOCl(aq) + NaCl(aq) + H2O (l). O hidróxido de sódio é utilizado na indústria alimentar para limpeza e descamação de frutas e legumes. Hidróxido de sódio é um ingrediente menor em muitos produtos comuns, mas em alguns pode constituir mais de metade do produto. Os dranocristais contêm entre 30% e 60% de hidróxido de sódio e alguns drenantes podem consistir em hidróxido de sódio a 100%. o hidróxido de sódio é um alcalino solúvel em água, com solubilidade de 1 g Em 1 ml de água. é utilizado para destruir os produtos químicos amargos das azeitonas que se vão transformar em azeitonas pretas. ele também funciona para neutralizar ácidos em vários produtos alimentares.
utiliza-se hidróxido de sódio para ajustar o pH do produto de modo a torná-lo mais aceitável para a pele. É comumente referido como soda cáustica, e muitas vezes serve como um reagente químico ao fazer sabão. Se demasiado concentrado pode causar irritação cutânea grave. o hidróxido de sódio é um dos produtos químicos industriais mais importantes. Em volume, está no top dez produtos químicos produzidos nos Estados Unidos. É usado na fabricação de um grande número de compostos, incluindo vários sais de sódio, no tratamento da celulose para a produção de rayon e celofane, e na fabricação de sabões, detergentes, polpa e papel. Hidróxido de sódio é um agente neutralizante comum para ácidos em titulações ácido-base e refinação de petróleo. Outra grande aplicação é extrair metais de seus minérios onde a fusão alcalina, como a fusão com soda cáustica, muitas vezes é aplicada para abrir os minérios. Adicionalmente, o hidróxido de sódio é usado para precipitar metais como hidróxidos. Outras utilizações são na recuperação da borracha, na dissolução da caseína na produção de Plásticos, na refinação de óleos vegetais, no processamento de têxteis, como eluente na cromatografia iónica, na gravação e na galvanoplastia, e como reagente laboratorial. Hidróxido de sódio também é usado como uma base forte em muitas síntese orgânica e reações catalisadas por base. as soluções de NaOH são usadas para neutralizar ácidos e fazer sais de sódio, por exemplo, na refinação de petróleo para remover ácidos sulfúricos e orgânicos; para tratar a celulose no fabrico de rayon viscose e celofane; na recuperação da borracha para dissolver o tecido; na fabricação de plásticos para dissolver caseína. As soluções de NaOH hidrolisam gorduras e formam sabões; precipitam alcalóides (bases) e a maioria dos metais (como hidróxidos) a partir de soluções de água dos seus sais. Ajuda farmacêutica (alkaliser).
preparação
hidróxido de sódio é produzido juntamente com cloro por electrólise de solução de cloreto de sódio. Vários tipos de células eletrolíticas são utilizados comercialmente. Eles incluem a célula de mercúrio, a célula de diafragma e a célula de membrana.
uma solução saturada de salmoura é eletrolizada. O gás cloro é liberado no ânodo e íon de sódio no cátodo. A decomposição da água produz íons de hidrogênio e hidróxido. O íon hidróxido combina-se com o íon de sódio formando NaOH. As reações eletrolíticas globais podem ser representadas como:
2Na+ + 2Cl – + 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
a célula de mercúrio prossegue em duas fases que ocorrem separadamente em duas células. O primeiro é conhecido como a célula de salmoura ou o eletrólito primário no qual o íon de sódio deposita no catodo de mercúrio formando amálgama, enquanto o gás cloro é liberado no ânodo:
Na+ + Cl – → Na-Hg(cátodo) + ½Cl2 (g) (ânodo)
Na segunda célula, conhecida como a célula de decomposição, um cátodo de grafite é usado enquanto amálgama de sódio serve como o ânodo. A água reage com o metal de sódio da amálgama na decomposição:
Na-Hg + H2O → na+ + OH– + ½H2 + Hg
nas células do diafragma de cloro-álcalis, um diafragma é empregado para separar o cloro libertado no ânodo do hidróxido de sódio e hidrogênio gerado no cátodo. Sem um diafragma, o hidróxido de sódio formado irá combinar com cloro para formar hipoclorito de sódio e clorato. Em muitas células, diafragmas de amianto são usados para tal separação. Muitos tipos de células de diafragma estão disponíveis.hidróxido de sódio é produzido sob a forma de um sólido anidro ou sob a forma de solução aquosa a 50%.
definição
a mais importante causa de morte comercial. o hidróxido de sódio é produzido por electrólise de electrólise de eléctrodos de usinginertes em salmoura. O cloro é desenvolvido como um gás no ânodo e o hidrogênio é desenvolvido como um gás no cátodo. A remoção de iões cloride e hidrogénio deixa iões de sódio e hidróxido em solução.A solução é seca para produzir o hidróxido de sódio sólido.um segundo método usa a célula Kellner–Solvay. A solução saturada de sodiumcloreto é eletrolizada entre um ânodo de carbono e um cátodo de mercúrio. Neste caso, o sódio é produzido no cátodo e não no hidrogénio, devido à prontidão do sódio para se dissolver no mercúrio. A amálgama sódio–mercúrio está, assim, exposta à água e é introduzida uma solução de hidróxido de sódio.
reacções
hidróxido de sódio é fortemente alcalino e pode reagir com ácidos para formar sais e água.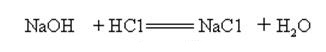
hidróxido de sódio reage com óxidos ácidos para formar sal e água, então hidróxido de sódio pode ser usado para absorver gases ácidos em laboratório ou industrialmente.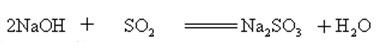
hidróxido de Sódio pode reagir com as soluções aquosas de muitos sais de metais para formar sais de sódio e hidróxidos de metal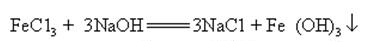
Quando o hidróxido de sódio e de amônia sal são aquecidos juntos, ele pode liberar amônia 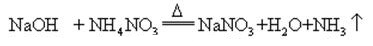
hidróxido de Sódio é altamente corrosivo, para que as garrafas de vidro armazenamento de soluções de hidróxido de sódio deve ser de borracha, rolhas e tampas de vidro não deve ser usado para impedir que uma reação química de abertura. Hidróxido de sódio é uma importante matéria-prima industrial, e pode ser produzido por eletrólise de solução salina industrialmente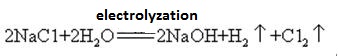
Descrição geral
Um sólido branco. Corrosivo aos metais e tecidos. Usado na indústria Química, refinação de petróleo, compostos de Limpeza, Produtos de limpeza de esgotos.
ar& reacções à água
solúveis em água. A dissolução pode libertar calor suficiente para causar vapor e espalhamento e inflamar material combustível adjacente .
perfil de reactividade
SODA cáustica (hidróxido de sódio) é uma base forte. Reage rápida e exotermicamente com ácidos, tanto orgânicos como inorgânicos. Facilmente absorve umidade do ar para dar semi-sólidos cáusticos que atacam alumínio e zinco com a evolução do gás hidrogênio inflamável. Catalisa a polimerização do acetaldeído e outros compostos polimerizáveis; essas reações podem ocorrer violentamente, por exemplo, a acroleína polimeriza-se com extrema violência quando colocado em contato com materiais alcalinos como hidróxido de sódio . Reage com grande violência com pentóxido de fósforo quando iniciado por aquecimento local . O contato (como um agente de secagem) com tetraidrofurano, que muitas vezes contém peróxidos, pode ser perigoso—explosões ocorreram em tal uso do hidróxido de potássio quimicamente similar . De mistura com qualquer uma das seguintes substâncias, em um recipiente fechado, causados a temperatura e a pressão a aumentar: glacial, ácido acético, anidrido acético, acroleína, chlorohydrin, chlorosulfonic ácido etileno cyanohydrin tama, glioxal, ácido clorídrico (36%), ácido fluorídrico (48.7%), ácido nítrico (70%), óleo, propiolactone, ácido sulfúrico (96%) . O contacto acidental entre uma solução de limpeza cáustica (provavelmente contendo hidróxido de sódio) e Pentol causou uma explosão violenta. . O aquecimento com uma mistura de álcool metílico e triclorobenzeno durante uma tentativa de síntese levou a um aumento súbito da pressão e uma explosão . O NaOH quente e / ou concentrado pode causar a decomposição da hidroquinona exotermicamente a temperatura elevada. (NFPA Pub. 491M, 1975, 385)
perigo
corrosivo para os tecidos em presença de hidratação, forte irritante para os tecidos (olhos, pele, mucosas e trato respiratório superior), envenenamento por ingestão. perigo para a saúde acção corrosiva forte nos tecidos contactados. Inalação: a poeira pode causar danos no próprio tracto respiratório superior e no próprio pulmão, produzindo de irritação ligeira do nariz a pneumonite. Ingestão: danos graves nas membranas mucosas; pode ocorrer formação ou perfuração de cicatrizes graves. Contacto visual: provoca danos graves. o hidróxido de sódio é uma substância altamente corrosiva que causa danos nos tecidos humanos.A sua acção na pele é um pouco diferente das queimaduras ácidas. Não há dor imediata, mas penetra na pele. Não coagulateproteína para evitar a sua penetração, e assim a queimadura cáustica pode tornar-se severa e lenta cicatrização. Derramar as suas soluções concentradas nos olhos pode resultar em várias vítimas ou lesões permanentes.é tóxico por ingestão, bem como por inalação da sua poeira. Embora se tenha verificado que a toxicidade oral de uma solução de 5-10% de soda cáustica é baixa nos animais de ensaio, doses elevadas em concentrações mais elevadas podem causar vómitos,prostração e colapso. Os coelhos letais orais dosein são de 500 mg / kg (NIOSH 1986).poeiras ou aerossóis de hidróxido de sódio são desencadeantes para os olhos, nariz e garganta. O prolongamento da exposição para concentrações elevadas no ar pode produzir ulceração da passagem nasal.
perigo de Incêndio
não combustível, a substância em si não queima, mas pode decompor-se após aquecimento para produzir fumos corrosivos e/ou tóxicos. Alguns são oxidantes e podem inflamar combustíveis (madeira, papel, óleo, vestuário, etc.). O contacto com metais pode provocar a formação de um gás de hidrogénio inflamável. Os recipientes podem explodir quando aquecidos. o hidróxido de sódio e o hidróxido de potássio não são inflamáveis como sólidos ou soluções aquosas .
aplicações farmacêuticas
o hidróxido de sódio é amplamente utilizado em formulações farmacêuticas para ajustar o pH das soluções. Ele também pode ser usado para reagir com fracos ácidos para formar sais.
utilizações industriais
soda cáustica (NaOH) é considerada como o regulador de pH alcalino mais forte. O sodais cáustico é uma substância muito activa e altamente corrosiva. A maior parte da soda cáustica é fabricada por electrólise de fios saturados (NaCl). A soda cáustica tem uma capacidade de regulação muito forte (isto é, de pH 7 a pH 14) a uma dosagem relativamente baixa em comparação com outras substâncias alcalinas. Comercialmente, a soda cáustica está disponível na forma anidra, mas na maioria das aplicações de mineração a soda cáustica é fornecida como uma solução de 50%.na indústria de processamento de minerais, hidróxido de sódio é usado principalmente para controle de alcalinidade durante o processamento de minerais não metálicos. Na flutuação de metais comuns, o uso de hidróxido de sódio é raro. perfil de segurança veneno por via intraperitoneal. Moderadamente tóxico por ingestão. Dados de mutação relatados. Um irritante corrosivo para a pele, olhos e membranas mucosas. Quando aquecido para decompor emite fumos tóxicos de NanO. o hidróxido de sódio é amplamente utilizado nas indústrias farmacêutica e alimentar e é geralmente considerado como um material não tóxico a baixas concentrações. Em concentrações elevadas é um irritante corrosivo para a pele, olhos e membranas mucosas.
DL50 (mouse, IP): 0.04 g / kg
DL50( rabbit, oral): 0.5 g / kg
exposição potencial
NaOH é utilizado para neutralizar ácidos e fazer sais de sódio na refinação de petróleo, raiom viscose; celofano, produção de plástico; e na recuperação de soluções dos seus sais. É usado na fabricação de algodão mercerizado, papel, explosivos e corantes na limpeza de Metais; extração eletrolítica de zinco; Revestimento de estanho; Revestimento De Óxido; lavagem, branqueamento, Lavagem de louça; e é usado nas indústrias químicas. durante o manuseamento destas substâncias, devem usar-se sempre cintas e luvas impermeáveis para evitar o contacto visual e visual. As operações com hidroxidesoluturas metálicas que tenham potencial para criar aerossóis devem ser realizadas em fumos para prevenir a exposição por inalação. NaOH e KOH geram calor considerável quando dissolvidos em água; ao misturarem-se com água, adicionam-se sempre cáusticos lentamente à água e agitam-se continuamente. Nunca adicionar água em quantidades limitadas a solididroxides. Os recipientes de hidróxidos devem ser armazenados num local fresco e seco, separados de ácidos e substâncias incompatíveis.
armazenagem
o hidróxido de sódio deve ser armazenado num Não-metal sólido hermético num local fresco e seco. Quando exposto ao ar, o sodiumidroxide absorve rapidamente a humidade e liquefaz-se, mas subsequentemente torna-se sólido devido à absorção de dióxido de carbono e à formação de carbonato de sódio.
expedição
UN1823 NaOH, sólido, Classe de perigo: 8; etiquetas: 8-material corrosivo. UN1824 NaOH, solução, Classe de perigo: 8; etiquetas: 8-material corrosivo
Métodos de purificação
as impurezas comuns são a água e o carbonato de sódio. O hidróxido de sódio pode ser purificado dissolvendo 100 g em 1L de EtOH puro, filtrando a solução sob vácuo através de um disco de vidro sinterizado fino para remover carbonatos e halogenetos insolúveis. (Esta e as operações subsequentes devem ser efectuadas numa caixa seca e isenta de CO2.) A solução é concentrada sob vácuo, usando aquecimento leve, para dar uma suspensão espessa do mono-alcoolato que é transferido para um disco de vidro sinterizado grosseiro e evacuado livre de licor-mãe. Depois de lavar os cristais várias vezes com álcool purificado para remover vestígios de água, eles são secos em um vácuo, com aquecimento leve, por cerca de 30 horas para decompor o alcoolato, deixando um pó branco cristalino fino . CAUSTICA. Soluções de hidróxido de sódio (cáustico), 14.77. Íon carbonatado pode ser removido por passagem através de uma coluna de troca de aniões (como o IRA-400 Amberlite; Oh–form). A coluna deve ser preparada de forma recente a partir da forma cloreto por uma passagem prévia lenta da solução de hidróxido de sódio até que o efluente não permita o ensaio de iões cloreto. Após o uso, a coluna pode ser regenerada por lavagem com HCl diluído, em seguida, água. Similarmente, outros íons metálicos são removidos quando uma solução de NaOH 1M (ou mais diluída) é passada através de uma coluna de resina de permuta iônica Dowex a-1 em sua forma Na+. Em alternativa, a contaminação por carbonatos pode ser reduzida através de varas de NaOH (Qualidade Analítica do reagente) rapidamente com H2O, dissolvendo-se em H2O destilado, ou preparando uma solução aquosa concentrada de NaOH e retirando o líquido sobrenadante límpido. (Na2CO3 insolúvel é deixado para trás. A contaminação por carbonato pode ser reduzida adicionando um ligeiro excesso de BaCl2 concentrado ou Ba (OH)2 a uma solução de NaOH, agitando bem e permitindo que o precipitado de BaCO3 se instale. Se a presença de Ba Na solução for inaceitável, pode ser utilizada uma purificação electrolítica. Por exemplo, a amálgama de sódio é preparada por electrólise de 3L de 30% NaOH com 500 ml de mercúrio puro para cátodo, e um ânodo de platina, passando por 15 Faradays a 4Amps, num frasco de polietileno de parede espessa. O frasco é então equipado com tubos de entrada e de saída, sendo a solução gasta eliminada por N2 Sem CO2. A amálgama é então lavada cuidadosamente com um grande volume de água desionizada (com a corrente de eletrólise ligada para minimizar a perda de Na). Por último, coloca-se uma haste de aço limpo em contacto NA solução com a amálgama (para facilitar a evolução do hidrogénio), permitindo-se que a reacção prossiga até se atingir uma concentração adequada, antes de ser transferida para um recipiente de armazenamento e diluída conforme necessário .
incompatibilidades
uma base forte e um oxidante forte. Reacção violenta com ácido. Incompatível com água; líquidos inflamáveis; halogéneos orgânicos, nitrometano e nitrocompounds, combustíveis. Absorve rapidamente dióxido de carbono e água do ar. O contacto com a humidade ou a água pode gerar calor. Corrosivo aos metais. Contato com zinco, alumínio, estanho e chumbo na presença de umidade, formando gás hidrogênio explosivo. Ataca algumas formas de plástico, borracha ou revestimentos.
incompatibilidades
o hidróxido de sódio é uma base forte e é incompatível com qualquer composto que sofra rapidamente hidrólise ou oxidação. Irá produzir efeitos com ácidos, ésteres e éteres, especialmente em solução aquosa. eliminação de resíduos descarga para o reservatório contendo água, neutralizar e, em seguida, descarregar para o esgoto com água.
estatuto regulamentar
GRAS listado. Aceite como aditivo alimentar na Europa.Incluído na Base de dados de ingredientes inactivos da FDA (preparações dentais, injecções; inalações; preparações nasais, oftálmicas, orais,Oticas, rectais, tópicas e vaginais). Inclui medicamentos para uso não-parental e para uso parentérico licenciados no Reino Unido. Incluída na lista de ingredientes não medicinais admissíveis do Estado-Membro.
Leave a Reply