Carbon: the essentials
Carbon is a Group 14 element and is distributed very widely in nature. É encontrado em abundância no sol, estrelas, cometas e atmosferas da maioria dos planetas. O carbono está presente como dióxido de carbono na atmosfera e dissolvido em todas as águas naturais. É um componente de rochas como carbonatos de cálcio (calcário), magnésio e ferro. A atmosfera de Marte é muito fina, mas o que existe contém cerca de 95% de CO2.o carvão, o petróleo e o gás natural são principalmente hidrocarbonetos. O carbono é único entre os elementos no vasto número de compostos que pode formar. Química Orgânica, um subconjunto 1/112 da química inorgânica, é o estudo do carbono e seus compostos. Enquanto o silício pode tomar o lugar do carbono na formação de uma série de compostos relacionados, não é possível atualmente formar compostos estáveis com cadeias muito longas de átomos de silício.
O carbono é encontrado livre na natureza em três formas alotrópicas: amorfo, grafite e diamante. A grafite é um dos materiais mais macios conhecidos, enquanto o diamante é um dos mais duros. O carbono, como diamantes microscópicos, é encontrado em alguns meteoritos. Diamantes naturais são encontrados em antigos “canos” vulcânicos, como encontrados na África do Sul. Os diamantes também são recuperados do fundo do oceano ao largo do cabo da Boa Esperança.

Um Anel de diamante.mais recentemente, outra forma de carbono, buckminsterfullerene, C60, foi descoberta. Esta forma de carbono é objeto de grande interesse em laboratórios de pesquisa hoje.
carbono puro está disponível em várias formas diferentes (alótropos). A forma mais comum de carbono puro É α-grafite. Esta é também a forma termodinamicamente mais estável. O diamante é uma segunda forma de carbono, mas é muito menos comum. Outras formas de carbono incluem os fulerenos. Enquanto diamantes e grafite são reticulados infinitos, fulerenos como buckminsterfullereno, C60, é uma espécie molecular discreta. As formas amorficas de carbono, tais como fuligem e lampblack, são materiais constituídos por partículas de grafite muito pequenas.
A maioria da grafite É α-grafite e possui uma estrutura de camada na qual cada carbono está diretamente ligado a três outros átomos de carbono a uma distância de 141,5 pm. A deslocalização na ligação é evidente uma vez que as distâncias C-C são iguais e menores que as ligações simples carbono-carbono normais (typcally 154 pm). A distância entre as camadas de átomos de carbono é de 335,4 pm. Na maioria dos grafite (α-grafite), as camadas de átomos são dispostas em um ABABABE… o empilhamento é ABCABCABC… embora as distâncias carbono-carbono e o espaçamento entre camadas permaneçam as mesmas que na forma α. A diferença de entalpia entre α-e α-grafite é inferior a 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1. As formas dos elementos mais pesados correspondentes à grafite não são conhecidas e as estruturas de silício, germânio e estanho cinzento estão relacionadas com a estrutura de diamante (abaixo).

arranjos atômicos nos alótropos mais comuns de carbono: α-grafite.dado que o diamante tem uma estrutura ligeiramente mais compacta, a sua densidade é superior à da grafite. A aparência do diamante é bem conhecida e é também um dos materiais mais duros conhecidos. Como a grafite, é relativamente pouco reativa, mas queima no ar a 600-800°C. Cada átomo de carbono Está ligado a quatro vizinhos a uma distância de 154,45 pm de forma tetraédrica e assim Cada cristal de diamante é uma única estrutura de retículo gigante. Em princípio (e na prática! a grafite pode ser convertida em diamante pela aplicação de calor e pressão. A célula unitária de diamante é cúbica com a = 356,68 pm. Quase todos os diamantes possuem esta estrutura, mas uma porcentagem muito pequena mostra uma estrutura hexagonal relacionada com wurtzite e estes são chamados de lonsdaleite.

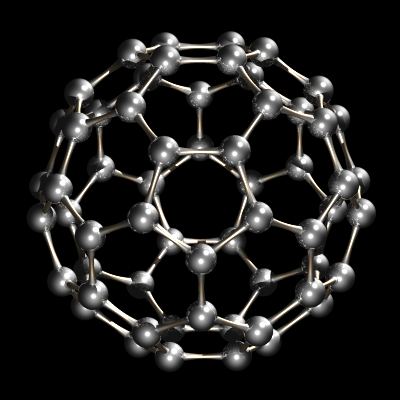
C60, Buckminsterfullerene.outros fulerenos (gaiolas de carbono fechadas) como C60 e C84 também são conhecidos e estão disponíveis comercialmente. O menor fulereno possível é o dodecaédrico C20, consistindo de 12 pentágonos e nenhum hexágono. Os nanotubos estão relacionados com fulerenos. Trata-se de tubos que apresentam o aspecto de grafite laminada, embora sejam feitos de grafite. Eles estão abertos enquanto fulerenos são estruturas fechadas.
uma característica interessante dos fulerenos é a sua capacidade de cercar átomos como o potássio e outros metais alcalinos para fazer estruturas endohedrais denotadas como K@C60.
In 1961 The International Union of Pure and Applied Chemistry (IUPAC) adopted the isotope 12C as the basis for atomic weights. Carbono-14, 14C, um isótopo com uma semi-vida de 5730 anos, é usado até à data, tais como madeira, espécimes arqueológicos, etc. Carbono-13, 13C, é particularmente útil para estudos de rotulagem isotópica, uma vez que não é radioativo, mas é um núcleo spin i = 1/2 e, portanto, um bom núcleo NMR.
Leave a Reply