Biologia para Cursos I
Resultados da Aprendizagem
- Identificar os componentes de simples reações químicas
Todos os elementos são mais estáveis quando os seus ultraperiféricas shell é preenchida com elétrons de acordo com a regra do octeto. Isto porque é energeticamente favorável para os átomos estarem nessa configuração e torna-os estáveis. No entanto, como nem todos os elementos têm elétrons suficientes para preencher suas conchas mais externas, os átomos formam ligações químicas com outros átomos, obtendo assim os elétrons que eles precisam para atingir uma configuração estável de elétrons. Quando dois ou mais átomos se ligam quimicamente um com o outro, a estrutura química resultante é uma molécula. A molécula familiar de água, H2O, consiste de dois átomos de hidrogênio e um átomo de oxigênio; estes se ligam para formar água, como ilustrado na Figura 1. Os átomos podem formar moléculas doando, aceitando ou compartilhando elétrons para preencher suas conchas externas.
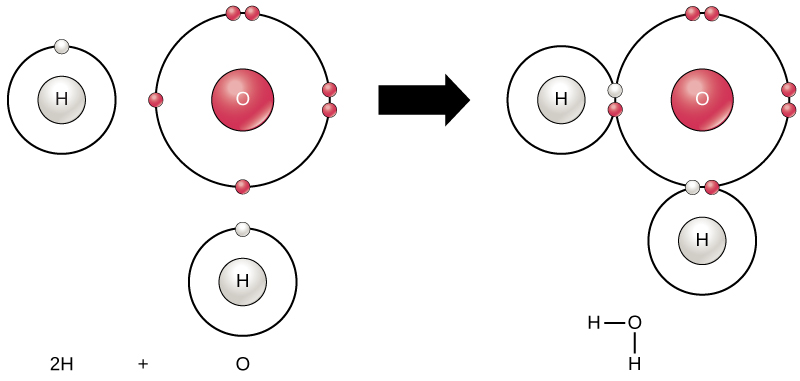
Figura 1. Dois ou mais átomos podem ligar-se uns aos outros para formar uma molécula. Quando dois hidrogenos e um oxigênio compartilham elétrons através de ligações covalentes, uma molécula de água é formada.as reações químicas ocorrem quando dois ou mais átomos se ligam para formar moléculas ou quando átomos ligados são quebrados. Substâncias utilizadas para o início de uma reação química são chamadas reagentes (geralmente encontrado no lado esquerdo de uma equação química), e as substâncias que se encontram no final da reação são conhecidos como os produtos (geralmente encontrado no lado direito de uma equação química). Uma seta é tipicamente desenhada entre os reagentes e produtos para indicar a direção da reação química; esta direção nem sempre é uma “via de Sentido Único”.”Para a criação da molécula de água mostrada acima, a equação química seria::
2h + o → H2O
um exemplo de uma reação química simples é a quebra de moléculas de peróxido de hidrogênio, cada uma das quais consiste em dois átomos de hidrogênio ligados a dois átomos de oxigênio (H2O2). O reagente peróxido de hidrogênio é dividido em água, contendo um átomo de oxigênio ligado a dois átomos de hidrogênio (H2O), e oxigênio, que consiste de dois átomos de oxigênio ligados (O2). Na equação abaixo, a reação inclui duas moléculas de peróxido de hidrogênio e duas moléculas de água. Este é um exemplo de uma equação química equilibrada, em que o número de átomos de cada elemento é o mesmo em cada lado da equação. De acordo com a lei de conservação da matéria, o número de átomos antes e depois de uma reação química deve ser igual, de modo que nenhum átomo é, em circunstâncias normais, criado ou destruído.
2H2O2 (peróxido de hidrogênio) → 2H2O(água) + O2 (oxigênio)
apesar de todos os reagentes e dos produtos dessa reação são moléculas (cada átomo permanece ligado a pelo menos um outro átomo), nesta reação, apenas o peróxido de hidrogênio e água são representativos de uma subclasse de moléculas conhecidas como compostos: eles contêm átomos de mais de um tipo de elemento. O oxigênio Molecular, por outro lado, como mostrado na Figura 2, consiste de dois átomos de oxigênio duplamente ligados e não é classificado como um composto, mas como um elemento.
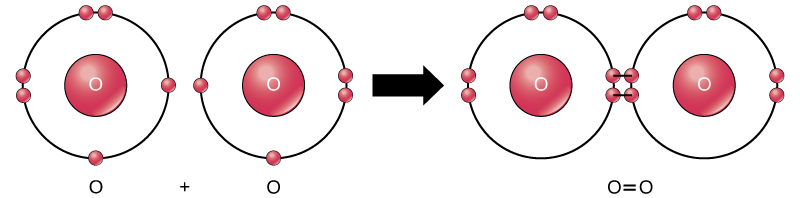
Figura 2. Os átomos de oxigênio em uma molécula de O2 são unidos por uma dupla ligação.
algumas reações químicas, como a mostrada acima, podem prosseguir em uma direção até que os reagentes sejam usados. As equações que descrevem essas reações contêm uma seta unidirecional e são irreversíveis. Reações reversíveis são aquelas que podem ir em qualquer direção. Em reações reversíveis, reagentes são transformados em produtos, mas quando a concentração do produto vai além de um certo limite (característica específica de reação), alguns desses produtos vai ser convertidos de volta em reagentes; neste ponto, as designações de produtos e reagentes são invertidos. Isto para a frente e para trás continua até que um certo equilíbrio relativo entre reagentes e produtos ocorra—um estado chamado equilíbrio. Estas situações de reações reversíveis são frequentemente denotadas por uma equação química com uma seta de duas cabeças apontando para os reagentes e produtos.por exemplo, no sangue humano, íons hidrogênio em excesso (h+) se ligam a íons bicarbonato (HCO3–) formando um estado de equilíbrio com ácido carbônico (H2CO3). Se o ácido carbônico fosse adicionado a este sistema, alguns deles seriam convertidos em bicarbonato e íons de hidrogênio.
HCO3– + H+ ↔ H2CO3
Em reações biológicas, no entanto, o equilíbrio é raramente obtido porque as concentrações de reagentes ou produtos, ou ambos, estão em constante mudança, muitas vezes com um produto de uma reacção ser um reagente para outro. Para retornar ao exemplo do excesso de íons hidrogênio no sangue, a formação de ácido carbônico será a principal direção da reação. No entanto, o ácido carbônico também pode deixar o corpo como gás dióxido de carbono (via exalação) em vez de ser convertido de volta para o íon bicarbonato, conduzindo assim a reação à direita pela lei química conhecida como Lei da ação de massa. Estas reacções são importantes para manter a homeostase do nosso sangue.
HCO3 – + H+ ↔ H2CO3 ↔ CO2 + H2O
no resumo: Reações químicas e moléculas
a camada exterior de elétrons dita quão prontamente e que tipo de ligações químicas um átomo particular se formará. A formação de compostos é frequentemente delineada visualmente em equações químicas que mostram os reagentes que participam em reações químicas para formar produtos.
tente It
contribuir!
melhore este pageLearn mais
Leave a Reply