9.4: Ionic Bonding
Energetics of Ionic Bond Formation
Ionic bonds are formed when positively and negatively charged ions are held together by electrostatic forces. Considere um único par de íons, um cátion e um ânion. Quão forte será a força da atracção deles? De acordo com a Lei de Coulomb, a energia de atração eletrostática (\(E\), entre duas partículas carregadas é proporcional à magnitude das cargas e inversamente proporcional à distância internuclear entre as partículas (\(r\)):
\
\
, onde cada íon de carga é representada pelo símbolo P. A constante de proporcionalidade k é igual a 2,31 × 10-28 J·m. Este valor de k inclui a carga de um único elétron (1.6022 × 10-19 C) para cada íon. A equação também pode ser escrita usando a carga de cada íon, expressa em coulombs (c), incorporada na constante. Neste caso, a constante de proporcionalidade, k, é igual a 8.999 × 109 J * m / C2. No exemplo dado, Q1 = + 1(1.6022 × 10-19 C) e Q2 = -1 (1.6022 × 10-19 c). Se Q1 e Q2 têm sinais opostos (como em NaCl, por exemplo, onde Q1 é +1 para Na+ e Q2 é -1 para Cl−), então E é negativa, o que significa que a energia é liberada quando oposta carregadas íons são reunidos a partir de uma distância infinita para formar um isolado ion par.
a energia é sempre liberada quando uma ligação é formada e correspondentemente, ela sempre requer energia para quebrar uma ligação.
conforme mostrado pela curva verde na metade inferior da figura \(\PageIndex{1}\), a energia máxima seria liberada quando os íons estão infinitamente próximos um do outro, em r = 0. Porque os íons ocupam espaço e têm uma estrutura com o núcleo Positivo sendo cercado por elétrons, no entanto, eles não podem estar infinitamente próximos um do outro. A distâncias muito curtas, as interações elétron-elétron repulsivas entre elétrons em íons adjacentes tornam-se mais fortes do que as interações atrativas entre íons com cargas opostas, como mostrado pela curva vermelha na metade superior da figura \(\PageIndex{1}\). A energia total do sistema é um equilíbrio entre as interações atrativas e repulsivas. A curva roxa na figura \(\PageIndex{1}\) mostra que a energia total do sistema atinge um mínimo de r0, o ponto onde as repulsões e atrações eletrostáticas são exatamente equilibradas. Esta distância é a mesma que a distância de ligação medida experimentalmente.
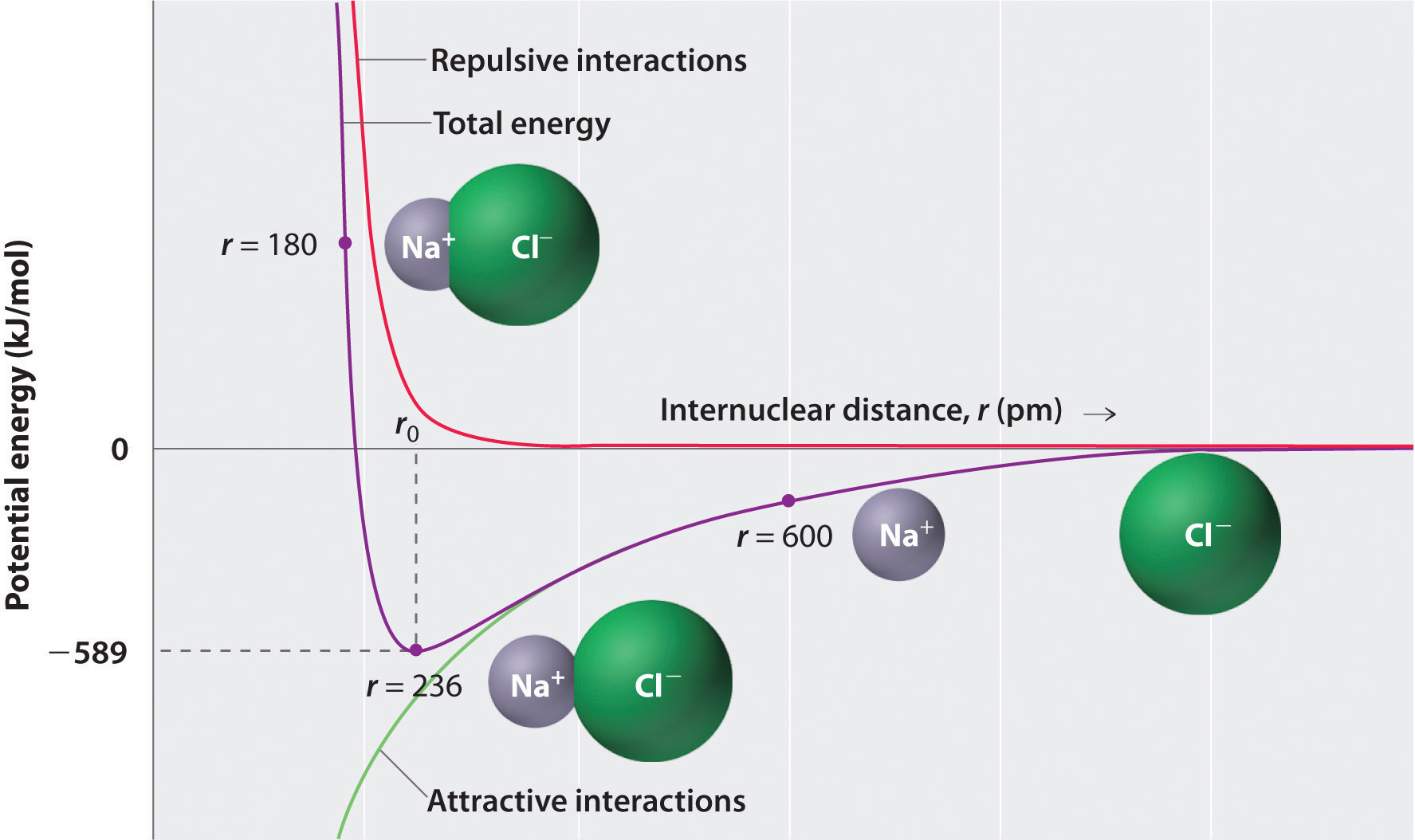
considere a energia liberada quando um íon gasoso \(na^+\) e um íon gasoso \(Cl^ -\) são reunidos de r = ∞ A r = r0. Dado que o observado em fase gasosa de distância internuclear é 236 pm, a mudança de energia associada com a formação de um íon par de um \(Na^+_{(g)}\) íon e um \(Cl^-_{(g)}\) íon é como segue:
\ &= (2.31 \times {10^{ – 28}}\rm{J}\cdot \ ‘cancelar’ {m} ) \left( \dfrac{( + 1)( – 1)}{236\; \cancelar{pm} \times 10^{ – 12} \cancelar{m/pm}} \right) \\ &= – 9.79 \ times 10^ {- 19}\; J / ion\; pair \label{Eq2} \end{align*}\]
O valor negativo indica que a energia é libertada. A nossa convenção é que, se um processo químico fornece energia ao mundo exterior, a mudança Energética é negativa. Se requer energia, a mudança de energia é positiva. Para calcular a mudança de energia na formação de um mole de pares de NaCl, precisamos multiplicar a energia por par de íons pelo número de Avogadro. :
\
Esta é a energia libertada quando 1 mol de pares de iões gasosos é formado, não quando 1 mol de iões positivos e negativos condensa para formar uma estrutura cristalina. Devido a interações de longo alcance na estrutura da estrutura da rede, esta energia não corresponde diretamente à energia da estrutura da rede do sólido cristalino. No entanto, o grande valor negativo indica que juntar íons positivos e negativos é energeticamente muito favorável, se um par de íons ou uma estrutura cristalina é formada.
nós resumimos os pontos importantes sobre ligação iónica:
- em r0, os íons são mais estáveis (têm uma energia potencial menor) do que a uma distância internuclear infinita. Quando íons opostos carregados são reunidos de R = ∞ A r = r0, a energia do sistema é reduzida (a energia é liberada).devido à baixa energia potencial em r0, a energia deve ser adicionada ao sistema para separar os íons. A quantidade de energia necessária é a energia de ligação.a energia do sistema atinge um mínimo a uma determinada distância internuclear (a distância de ligação).
exemplo \(\PageIndex{2}\): LiF
calcula a quantidade de energia libertada quando 1 mol de pares de iões li+F gasosos é formado a partir dos iões separados. A distância internuclear observada na fase gasosa é de 156 pm.
Dado: cátions e ânions, o montante e a distância internuclear
Perguntado: energia liberada a partir da formação de gases de iões de pares
a Estratégia:
Substitua os valores apropriados na Equação \(\ref{Eq1b}\) para obter a energia liberada na formação de um único íon par e, em seguida, multiplicar esse valor pelo número de Avogadro para obter a energia liberada por mole.solução:
Inserir os valores de Li+F− na Equação \(\ref{Eq1b}\) (onde Q1 = +1, Q2 = -1 e r = 156 pm), encontramos que a energia associada com a formação de um único par de Li+F− íons é
\ &=\left(2.31 \times 10^{-28} J⋅\ ‘cancelar’ {m} \right) \left(\dfrac{\texto{(+1)(-1)}}{156\; pm \times 10^{-12} \cancelar{m/pm}} \right)\\ &=-1.48 \times 10^{-18} \end{align*}\]
em Seguida, a energia liberada por mol de Li+F− íon de pares
\ &-891 \;kJ/mol \end{align*}\]
porque Li+ E F− são menores que na+ e Cl− (ver secção 7.3), a distância internuclear em LiF é menor que na NaCl. Consequentemente, de acordo com a equação \(\ref{Eq1b}\), é libertada muito mais energia quando se forma 1 mol de pares de iões li+F gasosos (-891 kJ/mol) do que quando se forma 1 mol de pares de iões Na+Cl gasosos (-589 kJ/mol).
exercício \(\PageIndex{2}\): óxido de magnésio
calcula a quantidade de energia libertada quando 1 mol de gás \(\ce{MgO}\) pares de iões são formados a partir dos iões separados. A distância internuclear na fase gasosa é de 175 pm.
Resposta
-3180 kJ/mol = -3.18 × 103 kJ/mol
Leave a Reply