związki kowalencyjne
masz teraz krótkie pojęcie o tym, dlaczego różne elementy zachowują się inaczej. Ale czy wiesz, że główną jego częścią jest „natura” wiązań w związkach. Podobnie jak ty i twoi najlepsi przyjaciele mają wiele różnic ze względu na” wewnętrzne ” cechy, tak jest w przypadku związków jonowych i kowalencyjnych. W tym rozdziale dowiemy się więcej o koncepcji związków kowalencyjnych, przyjrzymy się ich właściwościom i nie tylko.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Dzieje się tak dlatego, że atomy w cząsteczkach kowalencyjnych są bardzo mocno trzymane razem. Każda cząsteczka jest rzeczywiście całkiem oddzielna, a siła przyciągania między poszczególnymi cząsteczkami w związku kowalencyjnym wydaje się być słaba.
w rozdzielaniu cząsteczek potrzebujemy bardzo mało energii. Wynika to z sił przyciągania między cząsteczkami przy braku ogólnego ładunku elektrycznego. Związki kowalencyjne są zwykle cząsteczkami gazowymi w temperaturze pokojowej i ciśnieniu. Mogą to być również płyny o niskiej temperaturze wrzenia.
te cechy można przypisać ich słabym siłom międzycząsteczkowym, które utrzymują te atomy razem. Jednak mamy również wiele stałych związków kowalencyjnych. Mają niską temperaturę topnienia. Warto jednak zauważyć, że niewielka ich liczba ma zupełnie inną strukturę. Tworzą ogromne struktury, w których ogromna liczba atomów jest utrzymywana razem. Jest to możliwe dzięki obecności wspólnych elektronów.
te gigantyczne struktury molekularne są w zasadzie sieciami złożonymi z cząsteczek, które są połączone ze sobą przez wiązania kowalencyjne. Te wiązania kowalencyjne są bardzo silne. Są one również bardzo twarde o wysokich temperaturach topnienia, które różnią się od większości związków kowalencyjnych. Przykładem tego rodzaju związków kowalencyjnych jest diament i grafit sieci atomów węgla. Obejmują one również krzemionkę sieci atomów krzemu i tlenu.
Pobierz Chemical Bonding Cheat Sheet PDF, klikając przycisk Pobierz poniżej


Przeglądaj więcej tematów w zakładce Chemical Bonding And Molecular Structure
- parametry wiązania
- podstawy wiązania chemicznego
- hybrydyzacja
- wiązanie wodorowe
- związki jonowe lub elektrozaworowe
- teoria orbitali molekularnych
- polaryzacja wiązań
- struktury rezonansowe
- Wiązanie walencyjne Teoria
- teoria VSEPR
Ogólne właściwości związków kowalencyjnych
- związki kowalencyjne mają zwykle niską temperaturę topnienia. Wyjątkiem od tego są cząsteczki krzemionki i diamentów, które mają wysoką temperaturę topnienia.
- związki te mają niską temperaturę wrzenia. Można to przypisać ich słabej sile przyciągania między różnymi wiązanymi atomami. Siły Van Der Waalsa wiążą te atomy.
- związki te są zwykle gazami i cieczami o niskiej temperaturze wrzenia i topnienia.
- stałe związki kowalencyjne mają miękkie struktury, takie jak grafit. Wynika to z obecności chmury elektronów pomiędzy każdą warstwą atomów węgla.
- związki te nie są przewodnikami ładunku elektrycznego. Brak naładowanych jonów jest główną przyczyną tego. Wyjątkiem jest grafit, gdzie widzimy chmurę elektronów. To sprawia, że grafit jest dobrym przewodnikiem.
- też są złymi przewodnikami ciepła. Ich cząsteczkom brakuje wolnych elektronów, co utrudnia przepływ energii cieplnej.
- związki kowalencyjne nie posiadają właściwości polarnych jako własności ogólnej. Dlatego związki te są nierozpuszczalne w wodzie. Cząsteczki wody nie są absolutnie neutralne i mają niewielki ładunek ujemny na atomie tlenu i niewielkie ładunki dodatnie na atomach wodoru, a ponieważ związki kowalencyjne składają się z neutralnych cząsteczek lub cząsteczek o niewielkich ładunkach, a zatem nie są silnie przyciągane do cząsteczek wody.
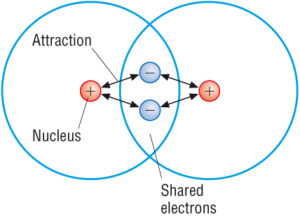
(źródło: Google)
Właściwości fizyczne i chemiczne
- ciekłe związki kowalencyjne odparowują. Oznacza to, że cząsteczki cieczy i ciał stałych tracą z ich powierzchni do powietrza.
- związki te mają bardzo mniejsze powinowactwo między swoimi cząsteczkami.
- różne związki kowalencyjne mają swoje charakterystyczne cząsteczki. Ich wiązania są skierowane na wcześniej ustawione kąty.
- niektóre związki, zwłaszcza leki, są rozpuszczalne w wodzie. Reszta jest rozpuszczalna w oleju.
- większość związków kowalencyjnych jest niepolarna lub ma bardzo małą tendencję do całkowitego rozpadu, tworząc jony, a zatem nigdy nie przewodzi elektryczności.
- w normalnej temperaturze i ciśnieniu związki te znajdziemy jako ciecze lub gazy. Ale są też ciała stałe i mają wyższą masę cząsteczkową.
- kryształy związków kowalencyjnych są dwóch typów: takiego, który ma słabą siłę van der Waala utrzymującą je razem, jak w jodzie. Są łatwo topliwe i lotne, inne mają dużą sieć atomów tworzących makrocząsteczki.
- związki te są rozpuszczalne w rozpuszczalnikach organicznych, takich jak eter i benzen.
- wiązania kowalencyjne mają charakter Kierunkowy. Dlatego wykazują zjawisko izomeryzmu.
- związki kowalencyjne mają bardzo powolną szybkość reakcji, w przeciwieństwie do różnych związków jonowych.
rozwiązane przykłady dla ciebie
pytanie: dlaczego związki kowalencyjne nie rozpuszczają się w wodzie?
odpowiedź: cząsteczki wody nie są absolutnie neutralne. Cząsteczki te mają niewielki ładunek ujemny na atomie tlenu i niewielki ładunek dodatni na atomach wodoru. Z drugiej strony, wiemy, że związki kowalencyjne składają się z obojętnych cząsteczek lub cząsteczek z niewielkimi ładunkami. Z tego powodu związki te nie są silnie przyciągane do cząsteczek wody.
Leave a Reply