wodorotlenek sodu
wodorotlenek sodu właściwości chemiczne,zastosowania,produkcja
właściwości chemiczne
wodorotlenek sodu jest białym, bezwonnym, nieulotnym materiałem alkalicznym sprzedawanym w postaci stałej jako granulki, płatki, grudki lub pałeczki. Jego rozpuszczalność w wodzie wynosi 111% masy i ciśnienie pary 0 mmHg (NOSH, 1994).
może reagować z tricholoetylenem (TCE) tworząc łatwopalny dichloroacetylen, a z metalami tworząc Gaz wodorowy (OEHHA, 1993). W odniesieniu do jednostek magazynujących i pojemników należy uwzględnić jego reaktywność z metalami.
wodorotlenek sodu jest powszechnie dostępny jako roztwór wodny znany jako soda kaustyczna, ług sodowy lub prosty jako ług. Ma różne zastosowania, w tym neutralizację kwasu; Produkcja papieru, Tekstyliów, tworzyw sztucznych, substancji żrących, barwników, farb, zmywaczy farb i mydła; rafinacja ropy naftowej; galwanizacja; czyszczenie metali; pranie; i mycie naczyń. Coraz częściej używa się nielegalnej produkcji metamfetaminy.
zastosowania
wodorotlenek sodu (NaOH) jest jednym z najbardziej użytecznych przemysłowych związków sodu. Jest również znany jako ług lub soda kaustyczna i jest jednym z najsilniejszych zasad zasadowych (wysoka wartość pH)na rynku gospodarstwa domowego. Jest stosowany jako środek do czyszczenia drenażu i piekarnika, a zmydla tłuszcze wwyprodukcja mydła. Należy go używać ostrożnie, ponieważ jest również zdolny do wytwarzania poważnych oparzeń skóry.
opis
wodorotlenek sodu, znany również jako ług i soda kaustyczna, jest wysoce żrącą substancją, która jest stosowana w niewielkich ilościach w kosmetykach do ustalenia i utrzymania pH produktu.Wodorotlenek sodu jest niezwykle ważnym związkiem w naszym życiu, ponieważ ma tak wiele zastosowań. Jest to bardzo powszechna baza stosowana w przemyśle chemicznym i jest używana do wielu rzeczy, z których wiele występuje w naszym codziennym życiu. Jednym z najbardziej znanych zastosowań wodorotlenku sodu jest jego zastosowanie w odprowadzaniu ścieków. Występuje w wielu różnych markach środków czyszczących, ale jednym z najczęstszych jest Drano. Występuje również w postaci mydła ługowego, które można wykorzystać do mycia praktycznie wszystkiego, od naczyń po twarz.
struktura wodorotlenku sodu
w temperaturze pokojowej wodorotlenek sodu jest białym krystalicznym bezwonnym ciałem stałym, które pochłania wilgoć z powietrza. Jest to substancja produkowana. Wodorotlenek sodu jest związkiem nieorganicznym stosowanym do kontrolowania poziomu pH lub służącym jako środek buforujący w kosmetykach i produktach do pielęgnacji ciała. Był historycznie stosowany w formułowaniu mydeł, ale obecnie występuje w różnych formułach, w tym produktach do kąpieli, produktach oczyszczających, zapachach, pudrach do stóp, farbach i kolorach do włosów, makijażu, produktach do paznokci, produktach do higieny osobistej, szamponach, produktach do golenia, depilatorach, produktach do pielęgnacji skóry i produktach do opalania, a także chemicznych prostownicach do włosów i zestawach fal do włosów. Jest również popularnym składnikiem rozpuszczalników przemysłowych jako baza chemiczna do mydeł, środków czyszczących piekarnik, detergentów i środków czyszczących drenaż ze względu na jego zdolność do rozpuszczania tłuszczu, olejów, tłuszczów i osadów na bazie białka, zgodnie z Wikipedią. Rzadziej wodorotlenek sodu jest postrzegany jako składnik past do zębów.
wodorotlenek sodu jest zatwierdzony przez FDA i otrzymał ocenę GRAS (ogólnie uznawaną za bezpieczną) jako bezpośredni dodatek do żywności. Jest jednak stosowany przede wszystkim w myciu i chemicznym peelingu produktów. Jest dopuszczony do stosowania w kosmetykach i produktach do pielęgnacji ciała w różnych stężeniach: 5% wagowych w rozpuszczalnikach do skórek paznokci, 2% wagowych w prostownicach do ogólnego użytku, 4,5% wagowych w prostownicach do użytku profesjonalnego, do pH 12,7 w depilatorach i do pH 11 w innych zastosowaniach jako regulator pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
właściwości chemiczne
wodorotlenek sodu, NaOH,określany również jako soda kaustyczna lub hydrat sodu(i wcześniej znany jako ług), jest białym,masywnym, rozpływającym się krystalicznym ciałem stałym,rozpuszczalnym w wodzie, alkoholu i glicerolu. Topi się w temperaturze 318°c (606 OF) i jest najczęściej używaną i dostępną substancją alkaliczną. Większość wodorotlenku sodu jest wytwarzana jako koprodukt chloru poprzez zastosowanie ogniw elektrolitycznych; ogniwa są typu membranowego, rtęciowego lub membranowego. Niektóre wodorotlenki sodu są oznaczone jako wytwarzane w komórkach; większość jest odparowywana i sprzedawana jako 50% i 73% roztwory lub jako bezwodne kulki. Większość żrących zastosowań końcowych wymaga roztworów o stosunkowo niskich stężeniach. Soda kaustyczna jest stosowana jako odczynnik analityczny i półprodukt chemiczny, w kąpielach do czyszczenia i czyszczenia,regeneracji gumy i rafinacji ropy naftowej, w kąpielach hartowniczych do obróbki cieplnej stali,w cięciu i rozpuszczalnych olejach,w mydłach i detergentach oraz w szerokiej gamie innych zastosowań.
właściwości chemiczne
NaOH jest białym, bezwonnym, rozpływającym się materiałem sprzedawanym jako granulki, płatki, grudki lub patyki. Roztwory wodne są znane jako ług sodowy
właściwości chemiczne
wodorotlenek sodu występuje w postaci białej lub prawie białej topionej masy. Jest dostępny w małych granulkach, płatkach, patyczkach i innych kształtach lub formach. Jest twardy i kruchy i wykazuje krystaliczne złamanie. Wodorotlenek sodu jest bardzo rozpływający się i pod wpływem powietrza szybko wchłania dwutlenek węgla i wodę.
właściwości fizyczne
białe kryształy rombowe, wytwarzane w postaci granulek, grudek, patyków, kulek, wiórków, płatków lub roztworów; higroskopijny; bardzo korozyjny; szybko absorbuje CO2 i wodę z powietrza; gęstość 2,13 g/cm3; topi się w temperaturze 323°C; odparowuje w temperaturze 1388°C; ciśnienie pary 1 torr w temperaturze 739°C i 5 torr w temperaturze 843°c; bardzo dobrze rozpuszczalny w wodzie (110 g/100 ml W temperatura), wytwarzając ciepło po rozpuszczeniu; roztwory wodne Silnie zasadowe, pH 0,5% roztworu około 13 i 0,05% roztworu około 12; rozpuszczalny w metanolu, etanolu i glicerolu (23,8 g/100 ml metanolu i 13.9 g/100 mL etanolu w temperaturze otoczenia.).
zastosowania
soda kaustyczna jest jednym z najczęściej używanychchemikalia. Stosuje się go do neutralizacji kwasów; do pobierania soli sodowych; do wytrącania metali wodorotlenków astheir; w rafinacji ropy naftowej; w tezaponifikacji estrów; w obróbce celulozy, tworzyw sztucznych i gumy; oraz w wielu zastosowaniach syntetycznych i analitycznych.
zastosowania
wodorotlenek sodu jest sprzedawany komercyjnie w postaci bezwodnych płatków lub granulek lub w postaci 50% lub 73% roztworów wodnych. Ma niezliczone zastosowania przemysłowe i jest jedną z 10 najlepszych substancji chemicznych pod względem produkcji i stosowania w skali globalnej. Rocznie zużywa się około 15 milionów ton wodorotlenku sodu. Jego największe wykorzystanie, zużywające około połowy produkcji, jest podstawą do produkcji innych chemikaliów. Służy do kontroli pH i neutralizacji kwasów w procesach chemicznych. Przemysł papierniczy szeroko wykorzystuje hydtlenek sodu w procesie roztwarzania. Wodorotlenek sodu służy do oddzielania włókien poprzez rozpuszczanie łączącej ligniny. Jest on stosowany w podobny sposób w produkcji sztucznego jedwabiu z celulozy. Wodorotlenek sodu jest kluczowym związkiem chemicznym w mydle industry.In w procesie zmydlania trójglicerydy uzyskane od zwierząt i roślin są podgrzewane w roztworze zasadowym w celu uzyskania glicerolu i mydła:
wodorotlenek sodu jest stosowany w przemyśle włókienniczym do bielenia i obróbki Tekstyliów w celu łatwiejszego barwienia. Przemysł naftowy wykorzystuje wodorotlenek sodu w płuczkach wiertniczych i bakteriobójczy asa. Podchloryn sodu (NaOCl) jest szeroko stosowany do czyszczenia i jako środek dezynfekujący.Zwykły wybielacz domowy składa się z około 5% roztworu podchlorynu sodu. Sodiumhypochloryn Wytwarza się w reakcji chloru z wodorotlenkiem sodu: Cl2(g) + 2NaOH(AQ) →NaOCl(AQ) + NaCl(aq) + H2O(l). Wodorotlenek sodu jest stosowany w przemyśle spożywczym do czyszczenia i obierania owoców i warzyw. Wodorotlenek sodu jest niewielkim składnikiem w wielu powszechnych produktach gospodarstwa domowego, ale w kilku może stanowić więcej niż połowę produktu. Dranokrystale zawierają od 30% do 60% wodorotlenku sodu, a niektóre środki czyszczące dreny mogą składać się w 100% z wodorotlenku sodu.
zastosowania
wodorotlenek sodu jest alkalią rozpuszczalną w wodzie, o rozpuszczalności 1 g w 1 ml wody. służy do niszczenia gorzkich chemikaliów w oliwkach, które mają stać się czarnymi oliwkami. działa również w celu neutralizacji kwasów w różnych produktach spożywczych.
zastosowanie
wodorotlenek sodu służy do regulacji pH produktu, aby był bardziej akceptowalny dla skóry. Jest powszechnie określany jako soda kaustyczna i często służy jako odczynnik chemiczny podczas wytwarzania mydła. Jeśli jest zbyt skoncentrowany, może powodować poważne podrażnienie skóry.
zastosowania
wodorotlenek sodu jest jedną z najważniejszych chemikaliów przemysłowych. Pod względem objętości znajduje się w pierwszej dziesiątce chemikaliów produkowanych w Stanach Zjednoczonych. Jest stosowany w produkcji dużej liczby związków, w tym kilku soli sodowych, w leczeniu celulozy do produkcji sztucznego jedwabiu i celofanu oraz w produkcji mydeł, detergentów, masy celulozowej i papieru. Wodorotlenek sodu jest powszechnym środkiem neutralizującym kwasy w miareczkowaniu kwasowo-zasadowym i rafinacji ropy naftowej. Innym ważnym zastosowaniem jest ekstrakcja metali z ich rud, w których do otwierania rud często stosuje się fuzję alkaliczną, taką jak fuzja z sodą kaustyczną. Dodatkowo wodorotlenek sodu stosuje się do wytrącania metali w postaci wodorotlenków. Inne zastosowania to regeneracja gumy, rozpuszczanie kazeiny w produkcji tworzyw sztucznych, rafinacja olejów roślinnych, przetwarzanie Tekstyliów, jako eluant w chromatografii jonowej, trawienie i galwanizacja oraz jako odczynnik laboratoryjny. Wodorotlenek sodu jest również stosowany jako silna zasada w wielu syntezach organicznych i reakcjach katalizowanych zasadą.
zastosowania
roztwory NaOH są stosowane do neutralizacji kwasów i wytwarzania soli sodowych, np. w rafinacji ropy naftowej w celu usunięcia kwasów siarkowych i organicznych; w leczeniu celulozy w wytwarzaniu wiskozowego jedwabiu i celofanu; w odzyskiwaniu gumy w celu rozpuszczenia tkaniny; w tworzeniu tworzyw sztucznych do rozpuszczania kazeiny. Roztwory NaOH hydrolizują tłuszcze i tworzą mydła; wytrącają alkaloidy (zasady) i większość metali (jako wodorotlenki) z wodnych roztworów ich soli. Środek farmaceutyczny (alkalizator).
preparat
wodorotlenek sodu jest wytwarzany razem z chlorem przez elektrolizę roztworu chlorku sodu. W handlu stosuje się różne typy ogniw elektrolitycznych. Należą do nich komórka rtęciowa, komórka membranowa i komórka membranowa.
nasycony roztwór solanki jest elektrolizowany. Gaz chloru jest uwalniany na anodzie, a jon sodu na katodzie. Rozkład wody wytwarza jony wodoru i wodorotlenku. Jon wodorotlenku łączy się z jonami sodu tworząc NaOH. Ogólne reakcje elektrolityczne można przedstawić jako:
2NA+ + 2CL-+ 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
komórka rtęciowa przebiega w dwóch etapach, które występują oddzielnie w dwóch komórkach. Pierwszy znany jest jako ogniwo solanki lub główny elektrolizer, w którym jon sodu osadza się na katodzie rtęciowej tworząc amalgamat, podczas gdy gaz chloru jest uwalniany na anodzie:
Na+ + Cl–→ Na-Hg (katoda) + ½Cl2(g) (anoda)
w drugiej komórce, znanej jako komórka rozkładająca, stosuje się katodę grafitową, podczas gdy amalgamat sodu służy jako anoda. Woda reaguje z metalem sodowym amalgamatu w rozkładaczu:
na-HG + H2o → na+ + OH– + ½H2 + Hg
w chloroalkalicznych ogniwach przeponowych stosuje się membranę do oddzielania chloru uwolnionego na anodzie od wodorotlenku sodu i wodoru wytworzonego na katodzie. Bez membrany powstały wodorotlenek sodu połączy się z chlorem, tworząc podchloryn sodu i chloran. W wielu komórkach do takiej separacji stosuje się przepony azbestowe. Dostępnych jest wiele rodzajów ogniw przeponowych.
wodorotlenek sodu jest wytwarzany w postaci bezwodnej substancji stałej lub w postaci 50% wodnego roztworu.
definicja
najważniejsza komercjalizacja.
metody produkcji
wodorotlenek sodu jest wytwarzany przez elektrolizę solanki przy użyciu elektrod. Chlor jest wyewoluowany jako gaz na anodzie i wodór jest wyewoluowany jako gaz na katodzie. Usunięcie jonów chlorkowych i wodorowych pozostawia jony sodu i wodorotlenku w roztworze.Roztwór suszy się w celu wytworzenia stałego wodorotlenku sodu.
druga metoda wykorzystuje komórkę Kellnera–Solvaya. Nasycony roztwór chlorku sodu jest elektrolizowany między anodą węglową a kwitnącą katodą rtęciową. W tym przypadku sód jest wytwarzany w katodzie, a nie w wodorze, ze względu na gotowość sodu do rozpuszczenia w rtęci. Amalgamat sodowo-rtęciowy poddawany jest działaniu wody i wytwarzany jest roztwór wodorotlenku sodu.
reakcje
wodorotlenek sodu jest silnie zasadowy i może reagować z kwasami tworząc sole i wodę.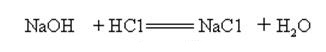
wodorotlenek sodu reaguje z kwaśnymi tlenkami, tworząc sól i wodę, więc wodorotlenek sodu może być stosowany do absorbowania kwaśnych gazów w laboratorium lub przemyśle.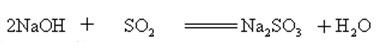
wodorotlenek sodu może reagować z wodnymi roztworami wielu soli metali, tworząc sole sodowe i wodorotlenki metali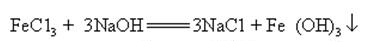
gdy wodorotlenek sodu i sól amoniakalna są podgrzewane razem, może uwalniać amoniak 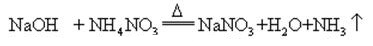
wodorotlenek sodu jest silnie żrący, więc szklane butelki zawierające roztwory wodorotlenku sodu muszą być gumowymi korkami, a szklanych korków nie należy stosować, aby zapobiec otwarciu reakcji chemicznej. Wodorotlenek sodu jest ważnym surowcem przemysłowym i może być wytwarzany przez elektrolizę roztworu soli fizjologicznej Przemysłowo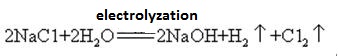
ogólny opis
białe ciało stałe. Działa korozyjnie na metale i tkanki. Stosowany w produkcji chemicznej, rafinacji ropy naftowej, związkach czyszczących, środkach czyszczących drenaż.
powietrze& reakcje wodne
rozpuszczalny w wodzie. Rozpuszczanie może wyzwolić wystarczającą ilość ciepła, aby spowodować parowanie i rozpryskiwanie oraz zapalić sąsiednie materiały palne .
profil reaktywności
SODA kaustyczna (wodorotlenek sodu) jest silną zasadą. Reaguje szybko i egzotermicznie z kwasami, zarówno organicznymi, jak i nieorganicznymi. Łatwo absorbuje wilgoć z powietrza, dając żrące półprodukty, które atakują aluminium i cynk wraz z ewolucją łatwopalnego gazu wodorowego. Katalizuje polimeryzację aldehydu octowego i innych polimeryzowalnych związków; reakcje te mogą wystąpić gwałtownie, na przykład akroleina polimeryzuje z ekstremalną przemocą, gdy jest w kontakcie z materiałami alkalicznymi, takimi jak wodorotlenek sodu. Reaguje z wielką przemocą z pięciotlenkiem fosforu, gdy jest inicjowany przez lokalne ogrzewanie . Kontakt (jako środek suszący) z tetrahydrofuranem, który często zawiera nadtlenki, może być niebezpieczny—wybuchy miały miejsce przy takim zastosowaniu chemicznie podobnego wodorotlenku potasu . Zmieszanie z którąkolwiek z następujących substancji w zamkniętym pojemniku spowodowało wzrost temperatury i ciśnienia: lodowaty kwas octowy, bezwodnik octowy, akroleina, chlorohydryna, kwas chlorosulfonowy, cyjanowodorek etylenu, glioksal, kwas solny (36%), kwas fluorowodorowy (48,7%), kwas azotowy (70%), oleum, propiolakton, kwas siarkowy (96%) . Przypadkowy kontakt żrącego roztworu czyszczącego (prawdopodobnie zawierającego wodorotlenek sodu) z Pentolem spowodował gwałtowną eksplozję. . Ogrzewanie mieszaniną alkoholu metylowego i trichlorobenzenu podczas próby syntezy doprowadziło do nagłego wzrostu ciśnienia i eksplozji . Gorący i / lub stężony NaOH może powodować egzotermiczny rozkład hydrochinonu w podwyższonej temperaturze. (NFPA Pub. 491m, 1975, 385)
Zagrożenie
żrące dla tkanek w obecności mois-ture, silnie drażniące dla tkanek (oczu, skóry, błon śluzowych i górnych dróg oddechowych), zatruwające przez strawienie.
zagrożenie dla zdrowia
silne działanie korozyjne na kontaktowane tkanki. Wdychanie: pył może spowodować uszkodzenie górnych dróg oddechowych i płuc, powodując od łagodnego podrażnienia nosa do zapalenia płuc. Spożycie: poważne uszkodzenie błon śluzowych; może wystąpić ciężka blizna lub perforacja. Kontakt wzrokowy: powoduje poważne uszkodzenia.
zagrożenie dla zdrowia
wodorotlenek sodu jest substancją silnie żrącą, która powoduje uszkodzenie tkanek ludzkich.Jego działanie na skórę jest nieco różneod oparzeń kwasem. Nie ma natychmiastowego bólu, ale przenika przez skórę. Nie koagulateproteina, aby zapobiec dalszej penetracji, a tym samym żrące oparzenie może stać się cięższei powolne gojenie. Rozlanie koncentrycznychrozwiązania do oczu może skutkować poważnymirytacją lub trwałym zranieniem.
jest toksyczny poprzez spożycie, jak również wdychanie pyłu. Chociaż stwierdzono, że toksyczność doustna 5-10% roztworu sody kaustycznej jest niska u badanych zwierząt,Wysokie dawki przy większych stężeniach mogą powodować wymioty, pokłony i zapaść. Doustna dawka śmiertelna w królikach wynosi 500 mg / kg (NOSH 1986).
pyły lub aerozole wodorotlenku sodu przenikają do oczu, nosa i gardła. Przedłużonyekspozycja do wysokich stężeń w powietrzu może powodować owrzodzenie kanału nosowego.
zagrożenie pożarowe
niepalna, sama substancja nie pali się, ale może rozkładać się podczas ogrzewania, aby wytworzyć korozyjne i / lub toksyczne opary. Niektóre są utleniaczami i mogą zapalać materiały palne (drewno, papier, olej, odzież itp.). W kontakcie z metalami może powstać łatwopalny gaz wodorowy. Pojemniki mogą eksplodować po podgrzaniu.
palność i wybuchowość
wodorotlenek sodu i wodorotlenek potasu nie są łatwopalne w postaci ciał stałych lub roztworów wodnych.
zastosowania farmaceutyczne
wodorotlenek sodu jest szeroko stosowany w preparatach farmaceutycznych w celu dostosowania pH roztworów. Może być również stosowany do reakcji ze słabymi kwasami, tworząc sole.
zastosowania przemysłowe
soda kaustyczna (NaOH) jest uważana za najsilniejszy zasadowy regulator pH. Żrąca sodajest bardzo aktywną substancją i jest silnie żrąca. Większość sody kaustycznej jest wytwarzana przez elektrolizę nasyconych solanek (NaCl). Soda kaustyczna ma bardzo silną zdolność pHregulatingcapability (tj. od pH 7 do pH 14) przy stosunkowo małej dawce w porównaniu do innych substancji alkalicznych. W handlu soda kaustyczna jest dostępna w postaci bezwodnej, ale w większości zastosowań górniczych soda kaustyczna jest dostarczana w 50% roztworze.
w przemyśle przetwórstwa minerałów wodorotlenek sodu jest najczęściej stosowany do kontroli zasadowości podczas przetwarzania minerałów niemetalicznych. W flotacji metali nieszlachetnych stosowanie wodorotlenku sodu jest rzadkie.
profil bezpieczeństwa
zatrucie drogą dootrzewnową. Umiarkowanie toksyczny po spożyciu. Raport z mutacji. Żrący środek drażniący skórę, oczy i błony śluzowe. Po podgrzaniu do rozkładu emituje toksyczne opary NanO.
bezpieczeństwo
wodorotlenek sodu jest szeroko stosowany w przemyśle farmaceutycznym i spożywczym i jest ogólnie uważany za nietoksyczny materiał o niskich stężeniach. W wysokich stężeniach jest żrącym środkiem drażniącym na skórę, oczy i błony śluzowe.
LD50 (mysz, IP): 0,04 g/kg
LD50 (królik, doustnie): 0,5 g/kg
potencjalna ekspozycja
NaOH jest wykorzystywana do neutralizacji kwasów i wytwarzania soli sodowych w rafinacji ropy naftowej, jedwab wiskozowy; celofan, produkcja tworzyw sztucznych; oraz w regeneracji roztworów ich soli. Jest stosowany do produkcji merceryzowanej bawełny, papieru, materiałów wybuchowych i barwników w czyszczeniu metali; elektrolityczna ekstrakcja cynku; cynowanie; powlekanie tlenkiem; pranie, wybielanie, zmywanie naczyń; i jest stosowany w przemyśle chemicznym.
przechowywanie
splashgoggles i nieprzepuszczalne rękawice powinny być noszone przez cały czas podczas obchodzenia się z tymi substancjami, aby zapobiec kontaktowi oczu ze skórą. Operacje z wodorotlenkami metali, które mogą tworzyć aerozole, powinny być prowadzone w dymie, aby zapobiec narażeniu przez wdychanie. NaOH i KOH generują znaczne ciepło, gdy rozpuszczają się w wodzie; podczas mieszania z wodą zawsze dodawać powoli substancje żrące do wody i mieszać w sposób ciągły. Nigdy nie dodawaj wody w ograniczonych ilościach do stałych wodorotlenków. Pojemniki z wodorotlenkami powinny być przechowywane w chłodnym, suchym miejscu, oddzielone od kwasów i niekompatybilnych substancji.
przechowywanie
wodorotlenek sodu powinien być przechowywany w hermetycznym niemetalicznym pojemniku w chłodnym, suchym miejscu. Po wystawieniu na działanie powietrza, wodorotlenek sodu szybko wchłania wilgoć i skrapla się, ale następnie staje się ponownie stały dzięki absorpcji dwutlenku węgla i przekształceniu węglanu sodu.
Wysyłka
UN1823 NaOH, solid, Klasa Zagrożenia: 8; etykiety: 8-Materiał korozyjny. UN1824 NaOH, roztwór, Klasa Zagrożenia: 8; etykiety: 8-Materiał korozyjny
metody oczyszczania
typowymi zanieczyszczeniami są woda i węglan sodu. Wodorotlenek sodu można oczyszczać rozpuszczając 100 g w 1 litrze czystego EtOH, filtrując roztwór pod próżnią przez drobno spiekany szklany dysk w celu usunięcia nierozpuszczalnych węglanów i halogenków. (Ta i kolejne operacje powinny być wykonywane w suchym, wolnym od CO2 pudełku.) Roztwór zatęża się pod próżnią, stosując łagodne ogrzewanie, w celu uzyskania gęstej zawiesiny monoalkoholanu, który jest przenoszony do gruboziarnistego dysku ze szkła spiekanego i opróżniany bez ługu macierzystego. Po przemyciu kryształów kilka razy oczyszczonym alkoholem w celu usunięcia śladów wody, są one suszone w próżni, z łagodnym ogrzewaniem, przez około 30 godzin w celu rozkładu alkoholu, pozostawiając drobny biały krystaliczny proszek . Żrący. Roztwory wodorotlenku sodu (żrące), 14.77. Jon węglanowy można usunąć przez przejście przez kolumnę wymiany anionowej(np. Amberlit IRA-400; Forma OH -). Kolumna powinna być świeżo przygotowana z postaci chlorkowej przez powolne wcześniejsze przejście roztworu wodorotlenku sodu, aż do momentu, gdy ściek nie wykaże obecności jonów chlorkowych. Po użyciu kolumnę można zregenerować poprzez przemywanie rozcieńczonym HCl, a następnie wodą. Podobnie, inne jony metali są usuwane, gdy 1m (lub więcej rozcieńczonych) roztwór NaOH jest przepuszczany przez kolumnę jonowymiennej żywicy A-1 Dowex w postaci Na+. Alternatywnie, zanieczyszczenie węglanem można zmniejszyć przez szybkie przepłukanie pałeczek NaOH (jakość odczynnika analitycznego) H2O, a następnie rozpuszczenie w destylowanym H2O lub przez przygotowanie stężonego wodnego roztworu NaOH i odciągnięcie przezroczystej cieczy nadsączowej. (Nierozpuszczalny Na2CO3 pozostaje w tyle.) Zanieczyszczenie węglanem można zmniejszyć przez dodanie Niewielkiego nadmiaru stężonego BaCl2 lub Ba(OH)2 do roztworu NaOH, dobrze wstrząsając i pozwalając osadowi BaCO3. Jeśli obecność Ba w roztworze jest niedopuszczalna, można zastosować oczyszczanie elektrolityczne. Na przykład amalgamat sodu Wytwarza się przez elektrolizę 3L 30% NaOH z 500 ml czystej rtęci na katodę i anodę platynową, przechodząc 1500 ml w temperaturze 400 ° C, w grubościennej butelce polietylenowej. Następnie butelka jest wyposażona w rurki wlotowe i wylotowe, a zużyty roztwór jest wypłukiwany przez wolny od CO2 N2. Następnie amalgamat dokładnie przemywa się dużą ilością wody dejonizowanej (z włączonym prądem elektrolizy, aby zminimalizować utratę Na). Na koniec, czysty stalowy pręt jest umieszczany w roztworze z amalgamatem (w celu ułatwienia ewolucji wodoru), z reakcją pozwalającą na kontynuowanie aż do osiągnięcia odpowiedniego stężenia, przed przeniesieniem do zbiornika magazynującego i rozcieńczeniem w razie potrzeby .
silna baza i Silny utleniacz. Gwałtowna reakcja z kwasem. Niekompatybilny z wodą; płyny łatwopalne; organiczne halogeny, nitrometan i związki Nitro, substancje palne. Szybko absorbuje dwutlenek węgla i wodę z powietrza. Kontakt z wilgocią lub wodą może generować ciepło. Działa korozyjnie na metale. Kontakt z cynkiem, aluminium, cyną i ołowiem w obecności wilgoci, tworząc wybuchowy gaz wodorowy. Atakuje niektóre formy tworzyw sztucznych, gumy lub powłok.
niezgodności
wodorotlenek sodu jest silną zasadą i jest niezgodny z dowolnym składnikiem, który łatwo ulega hydrolizie lub utlenianiu. Będzie reagować z kwasami, estrami i eterami, zwłaszcza w roztworze wodnym.
Usuwanie odpadów
odprowadzanie do zbiornika zawierającego wodę, zneutralizowanie, a następnie przepłukanie do kanalizacji wodą.
Status regulacyjny
Dopuszczony do stosowania jako dodatek do żywności w Europie.Zawarte w bazie danych nieaktywnych składników FDA (Preparaty dentystyczne; zastrzyki; inhalacje; preparaty do nosa, okulistyczne, doustne, otic,doodbytnicze, miejscowe i dopochwowe). Zawarte w lekach pozajelitowych i pozajelitowych licencjonowanych w Wielkiej Brytanii. Zawarte w kanadyjskim wykazie dopuszczalnych składników nieleczniczych.
Leave a Reply