Wiązanie chemiczne
wiązania chemiczne są atrakcjami między atomami, które utrzymują je razem, tworząc związki. Istnieją trzy główne rodzaje wiązania: wiązania kowalencyjne, które wiążą ze sobą związki molekularne, wiązania jonowe, które wiążą sole i kryształy jonowe oraz wiązania metaliczne, które wiążą Atomy metali.
cząsteczki i wiązania kowalencyjne
Większość paliw, tworzyw sztucznych i produktów naturalnych to związki molekularne, zbudowane z atomów połączonych ze sobą w cząsteczki. Rodzajem wiązania łączącego Atomy cząsteczki jest wiązanie kowalencyjne, które występuje, gdy zewnętrzne elektrony dwóch atomów są dzielone między nimi, tworząc przyciąganie między dwoma atomami.
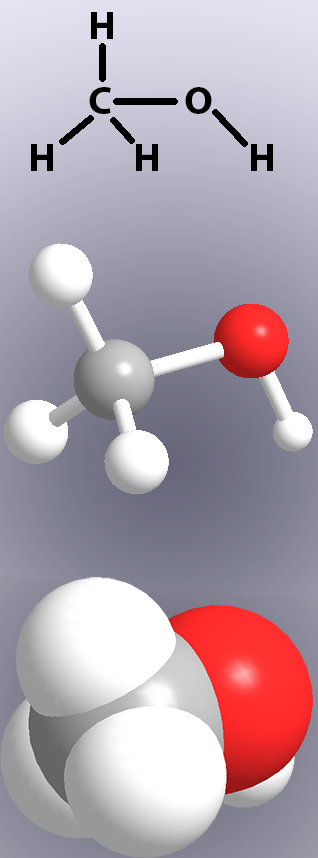
wiązania kowalencyjne są pokazane w strukturach chemicznych za pomocą linii (ryc. 1, góra), a w modelach poprzez pokazanie „patyków” lub nakładania się atomów (ryc. 1, środek i dół).
elektrony w wiązaniu kowalencyjnym nie zawsze są jednakowo dzielone między dwa atomy. Gdy dzielenie jest nierówne, jeden atom będzie miał bardzo niewielki ładunek dodatni, a drugi atom będzie nieco ujemny. Tworzy to mały dipol elektryczny-cząsteczki zawierające dipol są związkami polarnymi. To, czy cząsteczka jest polarna, czy niepolarna, wpłynie na jej właściwości, takie jak temperatura topnienia i wrzenia oraz wiązanie wodorowe.
Przeczytaj więcej o wiązaniu kowalencyjnym na stronie Chemistry LibreText.
wiązanie jonowe i metaliczne
podczas gdy wiązanie kowalencyjne obejmuje dzielenie elektronów między dwoma atomami, wiązanie jonowe obejmuje całkowite przeniesienie elektronów z jednego atomu do drugiego, tworząc jony dodatnie i ujemne. Jony te są następnie utrzymywane razem przez przyciąganie między przeciwnymi ładunkami. Związki jonowe tworzą kryształy oparte na tych atrakcjach.
Wiązanie metaliczne polega na całkowitym podziale elektronów walencyjnych atomów metalu, tworząc „morze elektronów”, w którym elektrony mogą swobodnie się poruszać. Jest to jeden z powodów wysokiej przewodności metali. Przeczytaj więcej o wiązaniu metalicznym w Libretext chemii
energia i wiązania chemiczne
ogólnie, energia zostanie uwolniona, gdy powstanie wiązanie między dwoma atomami, bez względu na rodzaj wiązania. Podobnie, jeśli Wiązanie istnieje już między dwoma atomami, energia będzie potrzebna, aby je złamać. Ilość energii potrzebnej do zerwania wiązania jest taka sama jak ilość energii uwolnionej, gdy się tworzy.
większość reakcji chemicznych polega zarówno na zerwaniu, jak i tworzeniu wiązań chemicznych. Jeśli energia uwalniana przez tworzenie nowych wiązań jest większa niż energia potrzebna do zerwania” starych ” wiązań, energia zostanie uwolniona przez reakcję. Energia ta może zostać utracona jako ciepło lub może być wykorzystana do zasilania.
na przykład spalanie metanu (CH4) następuje po tej reakcji chemicznej:
ta reakcja polega na zerwaniu czterech wiązań węgiel-wodór w metanie i wiązania tlen-tlen w O2. Nowe wiązania tworzą dwa wiązania węgiel-tlen (w CO2) i wiązania wodór-tlen (w H2o). Te nowe wiązania mają ogólnie mniej energii niż pierwotne wiązania, więc energia zostanie uwolniona w wyniku tej reakcji. Uwalnianie energii jest cechą charakterystyczną reakcji spalania-być może zauważyłeś to, gdy odczuwasz gorący płomień. Poniższa animacja ilustruje spalanie metanu w węglowodorach.
ponieważ duża ilość energii jest uwalniana podczas formowania CO2 i H2O podczas spalania węglowodorów, takich jak metan, są one dobrym źródłem energii pierwotnej. Oznacza to również, że duża ilość energii byłaby potrzebna do zerwania wiązań W CO2 i utworzenia innych cząsteczek. Jest to jeden z powodów, dla których fotosynteza wymaga tak dużo energii (od światła słonecznego), aby przekształcić CO2 w węglowodany.
więcej informacji
- energia chemiczna
- spalanie
- Energia pierwotna
- technologia konwersji energii
- lub przeglądaj losową stronę
Leave a Reply