Servier-Phlebolymphology
Pobierz ten numer powrót do podsumowania
kończyn dolnych:
aktualizacja i aktualne zalecenia
Bourgoin-Jallieu, Francja
Streszczenie
początkowo zakrzepica żył powierzchownych (SVT) była uważana za łagodną chorobę lub częste powikłanie.żylaków. Ostatnie badania wykazały potencjalne nasilenie SVT i określiły jego miejsce w obrębie żylnej choroby zakrzepowo-zatorowej (VTE) wraz z zakrzepicą żył głębokich (DVT) i zatorowością płucną (PE). Równoczesna zakrzepica żył głębokich stwierdzana była u 25% do 30% pacjentów w chwili prezentacji, a PE U 4% do 7% pacjentów. Kolejne ŻChZZ zgłaszano u 3 do 20% pacjentów, w zależności od czasu trwania obserwacji. Do niedawna przetestowano liczne strategie przeciwzakrzepowe, bez wyraźnie wykazanych korzyści klinicznych. Jednak w niedawnym badaniu CALISTO (porównanie produktu Arixtra w zakrzepicy żył powierzchownych kończyn dolnych z placebo) potwierdzono stosowanie protokołu leczenia przeciwzakrzepowego opartego na fondaparynuksie w dawce 2,5 mg na dobę przez 45 dni, co zaowocowało zaktualizowanymi zaleceniami dotyczącymi leczenia SVT. W tym artykule przedstawimy aktualizację zarządzania SVT dolnej części nogi oraz aktualne zalecenia i wytyczne. Krótko mówiąc, wszyscy pacjenci z SVT powinni mieć dwustronny dwustronny skan w celu potwierdzenia diagnozy SVT, określenia dokładnej lokalizacji i zakresu SVT oraz zdiagnozowania lub wykluczenia obecności DVT. U pacjentów z objawową SVT o długości co najmniej 5 cm, zaleca się przepisywanie profilaktycznej dawki fondaparynuksu lub heparyny o małej masie cząsteczkowej przez 45 dni bez przeciwzakrzepowej (Stopień 2B), A gdy koszt leczenia fondaparynuksem jest akceptowalny, zaleca się stosowanie fondaparynuksu w dawce 2,5 mg na dobę w porównaniu z heparyną o małej masie cząsteczkowej (Stopień 2C). Jednak zalecenia i wytyczne mają przypisane te zabiegi z niskim stopniu, i pytania pozostają o leczeniu SVT. Zidentyfikowano niektóre czynniki ryzyka późniejszego rozwoju żylnej choroby zakrzepowo-zatorowej, ale potrzebne są dalsze badania w celu określenia podgrup pacjentów z większą częstością występowania żylnej choroby zakrzepowo-zatorowej po SVT.
wprowadzenie
zakrzepica żył powierzchownych (SVT) została uznana za łagodną chorobę lub częste powikłanie żylaków; jednak ostatnie badania wykazały ich potencjalne nasilenie i określiły ich miejsce w obrębie żylnej choroby zakrzepowo-zatorowej (VTE), wraz z zakrzepicą żył głębokich (DVT) i zatorowością płucną (PE).
leczenie przeciwzakrzepowe jest obecnie szeroko stosowane zamiast niesteroidowych leków przeciwzapalnych (NLPZ), które były powszechnie stosowane do ostatniej dekady. Ostatnie badania po raz pierwszy potwierdziły protokół terapeutyczny.1 jednak nadal pozostają pytania dotyczące leczenia SVT: (i) czy leczenie przeciwzakrzepowe jest wymagane w leczeniu wszystkich pacjentów z SVT kończyn dolnych?; (ii) czy należy stosować dawki profilaktyczne lub terapeutyczne?; (iii) jaki jest zalecany czas trwania leczenia?; (iv)czy postępowanie powinno być takie samo w przypadku SVT występujących w żylakach i żylakach?; (v) czy czynniki ryzyka powikłań VTE po SVT można przewidzieć?; oraz (vi) czy zabieg chirurgiczny jest nadal wskazany w leczeniu ostrej SVT?
Ten artykuł przedstawi uzasadnienie aktualizacji dla zarządzania SVTs nóg oraz aktualne zalecenia i wytyczne.
częstość występowania zakrzepicy żył powierzchownych kończyn dolnych
SVT jest uważana za powszechną chorobę, ale rzeczywista częstość występowania w dorosłej populacji pozostaje nieznana. Ostatnie badanie, przeprowadzone we Francji, 2 wykazało, że roczna stopa diagnozy wynosiła 0,6%. Był wyższy u kobiet i zwiększał się wraz z wiekiem niezależnie od płci. Co zaskakujące, roczna diagnoza SVT była niższa niż oczekiwano i niższa niż roczna diagnoza DVT (o połowę niższa niż DVT). Według innego francuskiego badania, które przeprowadzono przy użyciu porównywalnych metod, roczna częstość występowania DVT i PE kończyny dolnej wynosiła odpowiednio 1,24% i 0,6%.3
zakrzepica żył powierzchownych ze współistniejącą zakrzepicą żył głębokich w prezentacji
POST (prospektywne obserwacyjne powierzchowne zakrzepowe zapalenie żył) i badania OPTIMEV (OPTimisation de l 'Interrogatoire dans l’ évaluation du risque throMbo – Embolique Veineux), dwa duże badania obserwacyjne i epidemiologiczne, niedawno opublikowały istotne dane dotyczące SVT.4,5 łącznie 844 pacjentów z SVT w nogach analizowano w badaniu POST, 4 i DVT lub PE zidentyfikowano u 25% pacjentów z SVT w prezentacji, a proksymalna DVT rozpoznano u 9,7% pacjentów. Należy podkreślić, że zakrzepica żył głębokich nie była związana z SVT u 41,9% pacjentów z zakrzepicą żył głębokich. Łącznie 788 pacjentów z SVT zostało włączonych do badania OPTMEV,5, w którym SVT wiązało się z DVT w momencie włączenia u 29% pacjentów, z dystalną DVT występującą u 59,5% tych pacjentów (128/215; dokładnej lokalizacji DVT brakowało u 12 pacjentów).
dane te potwierdzają wcześniejsze badania wykazujące, że DVT było związane z SVT U 23% do 36% pacjentów i wykazują spójność między różnymi badaniami (Tabela I).2,4-10
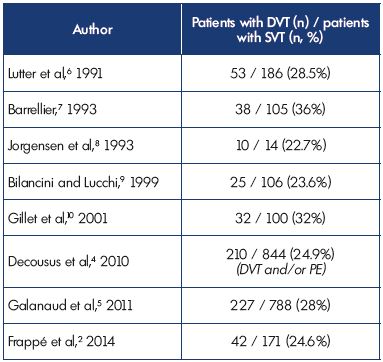
tabela I. zakrzepica żył powierzchownych ze współistniejącą zakrzepicą żył głębokich
w prezentacji.
skróty: DVT, zakrzepica żył głębokich; PE, zatorowość płucna; SVT,
zakrzepica żył powierzchownych.
zakrzepica żył powierzchownych związana z zatorowością płucną w czasie prezentacji
w momencie włączenia, objawowy PE rozpoznano u 3, 9% i 6.9% pacjentów w badaniach POST i OPTIMEV. Jednak SVT z PE, ale bez DVT, stanowiły tylko 2,2% wszystkich SVT z DVT lub PE. Dane te potwierdzają wyniki poprzednich badań (tabela II).2,4-7,9,10
w praktyce u pacjentów z SVT obowiązkowe jest badanie dwustronne w celu potwierdzenia diagnozy (ryc. 1), określenia dokładnej lokalizacji i zakresu SVT oraz zdiagnozowania lub wykluczenia obecności DVT.
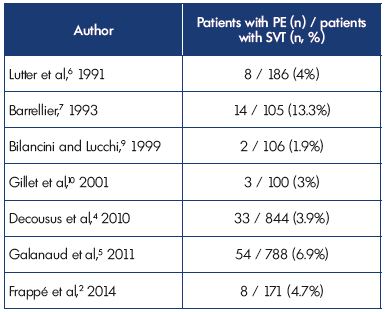
tabela II. zakrzepica żył powierzchownych ze współistniejącym zatorem płucnym w czasie prezentacji.
skróty: PE, zatorowość płucna; SVT, zakrzepica żył powierzchownych.
Rysunek 1. USG zakrzepicy małej żyły odpiszczelowej.

wynik i żylny nawrót zakrzepowo-zatorowy
w literaturze częstość nawrotów zakrzepowo-zatorowych waha się od 3% do 20% w zależności od czasu trwania obserwacji. W badaniu indywidualnym 13 zgłaszaliśmy występowanie objawowych VTE u 16,4% pacjentów z izolowaną SVT, ze średnią obserwacją wynoszącą 14,5 miesiąca. Zdarzenia żylne obejmowały DVT (31%), PE (6%), inną SVT w innym układzie odpiszczelowym (37,5%) i nawrotową SVT w tym samym układzie odpiszczelowym (25%).
w badaniu POST,4 8.U 3% pacjentów z izolowaną SVT w momencie włączenia wystąpił co najmniej jeden objawowy Epizod VTE po 3 miesiącach (objawowa DVT, 2,8%; objawowy PE, 0,5%; objawowe przedłużenie SVT, 3,3%; i objawowy nawrót SVT, 1,9%). W badaniu OPTIMEV U 5 3% pacjentów z izolowaną SVT i u 5,4% pacjentów z SVT związaną z DVT w prezentacji,wystąpiła żylna żylna choroba zakrzepowo-zatorowa po 3 miesiącach; częstość występowania żylnej żylnej choroby zakrzepowo-zatorowej wynosiła 12,5% W 3-letniej obserwacji. W badaniu przeprowadzonym przez Dewara i Panphera,U 4% pacjentów z izolowaną SVT po 6 miesiącach obserwacji wystąpiła objawowa zakrzepica żył głębokich.
te wyniki epidemiologiczne wskazują na potencjalne nasilenie SVT. Nie należy ich już uznawać za stan łagodny. W związku z tym ich miejsce zostało jasno określone w obrębie chorób ŻChZZ.
czynniki ryzyka wystąpienia zdarzenia zakrzepowo-zatorowego
Wielowymiarowa analiza wyników badania4 wykazała płeć męską, ZŻG lub ZP w wywiadzie, przebyty nowotwór i brak żylaków jako czynniki ryzyka objawowej ŻChZZ po 3 miesiącach, w tym nawrót lub przedłużenie SVT. W badaniu STENOX (powierzchowne zakrzepowe zapalenie żył leczone Enoksaparyną) jako niezależne czynniki prognostyczne dla żylnej choroby zakrzepowo-zatorowej po 3 miesiącach zidentyfikowano 15 przypadków żylnej choroby zakrzepowo-zatorowej (ZŻG lub ZP) w wywiadzie,płeć męską i ciężką przewlekłą niewydolność żylną. Jedynie ciężka przewlekła niewydolność żylna była niezależnym czynnikiem predykcyjnym DVT lub PE. W zbiorczej analizie badań POST i OPTIMEV,16 Galanaud i wsp. wykazało, że płeć męska, rak, osobista historia żylnej choroby zakrzepowo-zatorowej i zaangażowanie saphenofemoral lub saphenopopliteal znacząco zwiększały ryzyko późniejszej żylnej choroby zakrzepowo-zatorowej lub zakrzepowo-zatorowej (DVT/ PE) w analizie jednostkowej. W analizach wielowymiarowych tylko płeć męska znacząco zwiększała ryzyko wystąpienia kolejnych nawrotów ŻChZZ lub ZŻG/ZP. W przypadku raka i osobistej choroby zakrzepowo-zatorowej skorygowane współczynniki ryzyka były tylko nieznacznie niższe od poziomu istotności statystycznej (P = 0,06 dla obu), co sugeruje, że w przypadku tych czynników badanie nie miało wystarczającej mocy statystycznej.
w badaniu STEFLUX (powierzchowna choroba zakrzepowo-zatorowa FLUXum),wskaźnik masy ciała (BMI) między 25 a 30 kg/m2 pc.oraz złożony wynik wcześniejszej SVT i (lub) VTE i (lub) wywiadu rodzinnego VTE uznano za istotne niezależne czynniki ryzyka wystąpienia zdarzenia zakrzepowo-zatorowego (złożony z objawowej i bezobjawowej DVT, PE oraz nawrotu lub przedłużenia SVT).
stan żył
stwierdzono, że stan żylaków wpływa na ryzyko wystąpienia DVT w czasie prezentacji. W badaniach POST4 i OPTIMEV, 5 SVT występujących w żylakach (NVV-SVT) było częściej związanych ze współistniejącą ZŻG lub ZP niż SVT występujące w żylakach (VV-SVT). Podobne ustalenia zostały zgłoszone przez Gorty et al.
w 3-miesięcznym okresie obserwacji w badaniu OPTIMEV izolowane NVV-SVT nie wiązało się z większym ryzykiem wystąpienia działań niepożądanych (tj. zgonu, nawrotu ŻChZZ i krwawienia). Wyizolowane NVV-SVT miały większy związek z objawową nawrotem ZŻG lub PE (2,7% vs 0,6%), ale wynik ten nie osiągnął istotności statystycznej (P=0,07).
w badaniu POST, brak żylaków został zidentyfikowany jako czynnik ryzyka późniejszego rozwoju objawowej żylnej choroby zakrzepowo-zatorowej u pacjentów z izolowaną objawową SVT w momencie wystąpienia choroby (P=0, 049). W badaniu STEFLUX brak żylaków był czynnikiem ryzyka VTE (p=0,004) po przerwaniu leczenia heparyną o małej masie cząsteczkowej.
w grupie placebo w badaniu CALISTO (porównanie produktu Arixtra w zakrzepicy żył powierzchownych kończyny dolnej z placebo),1 powikłania zakrzepowo-zatorowe występowały częściej, gdy SVT dotyczyła Wielkiej żyły odpiszczelowej (GSV), została przedłużona do 10 cm od węzła odpiszczelowo-udowego (SFJ), obejmowała żyły powyżej kolana oraz u pacjentów z żylną żylną żylną w wywiadzie.
zastój żylny jest podstawowym mechanizmem SVT u pacjentów z żylakami. Zapalenie może odgrywać istotną rolę w tworzeniu skrzepliny u pacjentów bez żylaków; tym samym zwiększa ryzyko wystąpienia bardziej klinicznie poważnej choroby zakrzepowo-zatorowej. Badania przesiewowe w kierunku trombofilii nie są zalecane w rutynowym leczeniu pacjentów z NVV-SVT, chociaż dane z literatury wykazały, że trombofilia była częsta w tej sytuacji. W indywidualnym badaniu prospektywnym 10 zidentyfikowano trombofilia u 50% pacjentów z NVV-SVT, podczas gdy tylko 15% pacjentów z VV-SVT miało trombofilia. W innym badaniu prospektywnym z udziałem 42 pacjentów z NVV-SVT, 19 zidentyfikowano trombofilia U 20 (47,6%) pacjentów. Najczęstszą trombofilią była mutacja heterozygotyczna czynnika V Leidena. W badaniu z udziałem 63 pacjentów z izolowanym NVV-SVT,20 Martinelli i wsp. zidentyfikowało trombofilia u 30% pacjentów. Po wykluczeniu raka utajonego zaleca się przeprowadzenie badań przesiewowych w kierunku trombofilii, zwłaszcza u pacjentów z progresją zakrzepu pomimo odpowiedniego leczenia przeciwzakrzepowego.11,21
leczenie zakrzepicy żył powierzchownych
leczenie SVT zawsze było tematem kontrowersyjnym. Duże różnice w leczeniu są zgłaszane, zwłaszcza w odniesieniu do leczenia przeciwzakrzepowego. Badanie POST 4 przeprowadzone we Francji w okresie od marca 2005 r.do października 2006 r. dostarczyło interesujących informacji dotyczących leczenia SVT. Łącznie 634 pacjentów miało izolowaną SVT w momencie włączenia. Informacje na temat leczenia, które otrzymali podczas 3-miesięcznego okresu obserwacji, były dostępne dla 597 pacjentów, przy czym 90,5% pacjentów otrzymało jeden lub więcej leków przeciwzakrzepowych. Spośród pacjentów otrzymujących leczenie przeciwzakrzepowe, 63% otrzymało dawki terapeutyczne, 36,7% dawki profilaktyczne, a 16,8% antagonistów witaminy K. Czas trwania leczenia był bardzo zmienny. W sumie 47.2% pacjentów otrzymało miejscowe NLPZ, 8,2% doustne NLPZ, a 10% miało operację żylną (stripping lub wysokie podwiązanie).
dane te wykazały konieczność wyjaśnienia roli leczenia przeciwzakrzepowego w leczeniu SVT. Zastosowanie terapii przeciwzakrzepowej u pacjentów z SVT zostało po raz pierwszy zgłoszone w 1962 r.przez Zollingera i wsp. 22 po zaobserwowaniu wystąpienia PE,który był śmiertelny u 34 (10,1%) z serii 335 pacjentów z SVT. Do niedawna, chociaż przetestowano liczne strategie przeciwzakrzepowe, w tym heparynę niefrakcjonowaną lub heparynę o małej masie cząsteczkowej, w dawkach profilaktycznych lub terapeutycznych przez różne okresy, żadna z nich nie wykazała wyraźnie żadnych korzyści klinicznych.
badanie STENOX23 było randomizowanym, podwójnie zaślepionym badaniem z udziałem 427 pacjentów, w którym porównywano heparynę o małej masie cząsteczkowej (enoksaparynę w dawkach terapeutycznych i profilaktycznych) z NLPZ i placebo. Pacjenci byli leczeni przez 10 dni z 3-miesięczną obserwacją. Po 10 dniach w grupie placebo wystąpiło więcej ŻChZZ (P24 w porównaniu z dawkami terapeutycznymi i profilaktycznymi nodraparyny u 163 pacjentów z izolowaną SVT w GSV, a pacjenci byli leczeni przez 1 miesiąc. W 3-miesięcznym okresie obserwacji wyniki były podobne w obu grupach (odpowiednio 7,2% i 8,6% przypadków żylnej choroby zakrzepowo-zatorowej; p=0,7), nie wykazując korzyści z dawkowania terapeutycznego. W okresie obserwacji obserwowano zjawisko „dogonienia” lub odbicia, ponieważ zgłaszano wiele przypadków żylnego zapalenia stawów, zwłaszcza w grupie pacjentów leczonych dawką terapeutyczną. Zjawisko „doganiania” zaobserwowano również po przerwaniu leczenia heparyną niskocząsteczkową po 1 miesiącu w badaniu STEFLUX.Wyniki te, podobnie jak wyniki badania STENOX, przemawiają za wyborem dawek profilaktycznych heparyny niskocząsteczkowej w SVT. Występowanie większości VTE w ciągu 2 i 3 miesięcy po przerwaniu leczenia heparyną niskocząsteczkową w grupie otrzymującej dawki terapeutyczne ponownie podkreśla kwestię optymalnego czasu trwania leczenia przeciwzakrzepowego.
w randomizowanym, podwójnie zaślepionym badaniu CALISTO1 porównywano fondaparynuks w dawce 2, 5 mg na dobę przez 45 dni z placebo u 3002 pacjentów z izolowaną objawową SVT kończyny dolnej o długości co najmniej 5 cm. Głównymi kryteriami wykluczenia były leczenie raka w ciągu ostatnich 6 miesięcy, ZŻG lub ZP w ciągu poprzednich 6 miesięcy, SVT zlokalizowane w odległości 3 cm od SFJ oraz ciężka niewydolność nerek (klirens kreatyniny 26 wybrano dawkę 2, 5 mg fondaparynuksu z myślą, że dawka profilaktyczna będzie wystarczająca do leczenia pacjentów z SVT. Ponadto wykazano, że dawka ta jest skuteczniejsza w zapobieganiu VTE po dużych operacjach ortopedycznych niż dawka profilaktyczna heparyny o małej masie cząsteczkowej i równie skuteczna jak dawka terapeutyczna heparyny o małej masie cząsteczkowej u pacjentów z ostrymi zespołami wieńcowymi, co sugeruje, że 2,5 mg fondaparynuksu odpowiada zaleceniom Amerykańskiego Kolegium Lekarzy klatki piersiowej (ACCP) z 2008 r. 27, które zalecają stosowanie zarówno profilaktycznej, jak i pośredniej dawki heparyny o małej masie cząsteczkowej w leczeniu pacjentów z SVT. Wybrano czas trwania 45 dni, ponieważ okres leczenia wynoszący 30 dni lub mniej może być zbyt krótki, ponieważ większość objawowych VTE występuje po przerwaniu leczenia. Pierwszorzędowym wynikiem skuteczności był złożony zgon z jakiejkolwiek przyczyny, objawowy PE, objawowa DVT, objawowe rozszerzenie SFJ lub objawowy nawrót SVT w dniu 47. Okres obserwacji wynosił 77 dni.
pierwszorzędowy wynik skuteczności wystąpił u 0, 9% pacjentów w grupie fondaparynuksu i U 5.9% w grupie placebo (P28
warto zauważyć zmianę zaleceń z wytycznych ACCP 2008.27 musimy jednak wziąć pod uwagę, że są to zalecenia niskiej jakości (Stopień 2b lub 2C).
w zaktualizowanym przeglądzie systematycznym bazy danych Cochrane dotyczącym „leczenia powierzchownego zakrzepowego zapalenia żył kończyn dolnych”29,30 Di Nisio i wsp.doszli do tych samych wniosków. Przegląd ten został oparty na analizie 30 randomizowanych kontrolowanych badań z udziałem 6507 uczestników z SVT nóg. Autorzy doszli do wniosku, że profilaktyczna dawka fondaparynuksu podawana przez 6 tygodni wydaje się być prawidłową opcją terapeutyczną SVT nóg. Dane dotyczące leczenia doustnego, leczenia miejscowego lub zabiegu chirurgicznego są zbyt ograniczone i nie dostarczają informacji do wykorzystania w praktyce klinicznej na temat skutków tych zabiegów w zakresie progresji żylnej choroby zakrzepowo-zatorowej i SVT.
leczenie chirurgiczne a leczenie przeciwzakrzepowe
przegląd badań porównujących leczenie chirurgiczne z leczeniem przeciwzakrzepowym nie wykazuje żadnych korzyści z leczenia chirurgicznego. Częstość progresji SVT była podobna, podczas gdy częstość występowania żylnej choroby zakrzepowo-zatorowej i powikłań była większa podczas operacji.Lozano i wsp. nie wykazali żadnej różnicy między operacją a enoksaparyną przez 4 tygodnie.32
ryc. 2. USG rozszerzenia zakrzepicy żyły odpiszczelowej Wielkiej do wspólnej żyły udowej.
skróty: CFV, wspólna żyła udowa; GSV, Wielka żyła odpiszczelowa
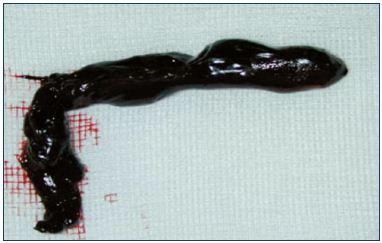
Rysunek 3. Zakrzepica węzła odpiszczelowo-udowego.
Zdjęcie dzięki uprzejmości Dr Nicolini.

w praktyce większość ekspertów zaleca leczenie pacjentów z SVT rozszerzoną w SFJ lub SPJ terapią przeciwzakrzepową w dawkach terapeutycznych przez 3 miesiące.
wnioski
SVT nie należy już uznawać za łagodną chorobę. Ostatnie badania epidemiologiczne, które objęły dużą liczbę pacjentów, wykazały potencjalne nasilenie SVT i jasno określiły ich miejsce w obrębie chorób ŻChZZ. Równoczesna zakrzepica żył głębokich stwierdzana była u 25% do 30% pacjentów w chwili prezentacji, a PE U 4% do 7% pacjentów. W związku z tym wszyscy pacjenci z SVT powinni mieć dwustronne skanowanie dwustronne w celu potwierdzenia diagnozy SVT, określenia dokładnej lokalizacji i zakresu SVT oraz zdiagnozowania lub wykluczenia obecności DVT. Obecnie zarządzanie SVT zmieniło się, a terapia przeciwzakrzepowa jest szeroko stosowana zamiast NLPZ. Do czasu niedawnego badania preparatu CALISTO żaden protokół leczenia przeciwzakrzepowego nie wykazał wyraźnych korzyści klinicznych. Zalecenia zostały zaktualizowane po tym, jak w badaniu CALISTO potwierdzono protokół leczenia przeciwzakrzepowego oparty na fondaparynuksie w dawce 2,5 mg na dobę przez 45 dni. U pacjentów z objawową SVT nóg o długości co najmniej 5 cm zaleca się profilaktyczną dawkę fondaparynuksu lub heparyny o małej masie cząsteczkowej przez 45 dni w przypadku braku przeciwzakrzepowej (Stopień 2b). Jeśli koszt leczenia fondaparynuksem jest akceptowalny, zaleca się stosowanie fondaparynuksu w dawce 2,5 mg na dobę w profilaktycznej dawce heparyny o małej masie cząsteczkowej (Stopień 2C). Zalecenia i wytyczne są jednak niskiej jakości i nadal pozostają pytania dotyczące zarządzania SVT. Zidentyfikowano niektóre czynniki ryzyka późniejszego rozwoju żylnej choroby zakrzepowo-zatorowej, ale potrzebne są dalsze badania w celu jasnego określenia podgrup pacjentów z większą częstością żylnej choroby zakrzepowo-zatorowej po SVT.
2. Frappé P, Buchmuller-Cordier a, Bertoletti L, et al; STEPH Study Group. Roczna diagnoza zakrzepicy żył powierzchownych kończyn dolnych: badanie STEPH oparte na społeczności. J Thromb Hemost. 2014;12:831-838.
3. Oger E; grupa badawcza EPI-GETBO. Częstość występowania żylnej choroby zakrzepowo-zatorowej: badanie wspólnotowe w zachodniej Francji. Thromb Hemost. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; POST Study Group. Powierzchowna zakrzepica żylna i żylna choroba zakrzepowo-zatorowa: Duże, prospektywne badanie epidemiologiczne. Ann Intern Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; Optimev SFMV Investigators. Czynniki prognostyczne współistniejącej zakrzepicy żył głębokich i objawowego żylnego nawrotu zakrzepowo-zatorowego w przypadku powierzchownej zakrzepicy żylnej. Thromb Hemost. 2011;105:31-39.
6. Lutter KS, Kerr TM, Roedersheimer R, Lohr JM, Sampson MG, Cranley JJ. Powierzchowne zakrzepowe zapalenie żył diagnozowane przez skanowanie dwustronne. Operacja. 1991;100:42-46.
7. Barrellier MT. Thromboses veineuses superficielles des membres inférieurs . Actual Vasc Int. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Hunt JM. Częstość występowania zakrzepicy żył głębokich u pacjentów z powierzchownym zakrzepowym zapaleniem żył kończyn dolnych. J Vasc 1993;18: 70-73.
9. Bilancini S, Lucchi M. Les thromboses veineuses superficielles sont-elles polymorphes ? Phlébologie. 1999;52:41-43.
10. G illet JL, Perrin m, Cayman R. powierzchowna zakrzepica żylna kończyn dolnych: analiza prospektywna u 100 pacjentów . J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Zakrzepica żył powierzchownych: stwierdzenie konsensusu. Int Angiol. 2012;31:203-216.
12. Nicolaides A. Zakrzepica żył powierzchownych w profilaktyce i leczeniu żylnej choroby zakrzepowo-zatorowej. Int Angiol. 2013;32:237-242.
13. G illet JL, Perrin m, Cayman R. nawrót zakrzepowo-zatorowy po powierzchownym zakrzepowym zapaleniu żył kończyn dolnych. J Flebologia. 2002;2:103-118.
14. D ewar C, Panpher S. częstość występowania zakrzepicy żył głębokich u pacjentów z rozpoznanym zakrzepowym zapaleniem żył powierzchownych po przedstawieniu do oddziału ratunkowego ambulatoryjnej usługi zakrzepicy żył głębokich. Emerg Med J. 2010;27: 758-761.
15. Quenet S, Laporte S, Décousus H, Leizorovicz a, Epinat M, Mismetti P; Grupa STENOX. Czynniki predykcyjne powikłań zakrzepicy żylnej u chorych z izolowaną zakrzepicą żył powierzchownych. J Vasc 2003; 38: 944-949.
16. G alanaud JP, Bosson Jl, Genty C, et al. Zakrzepica żył powierzchownych i nawracająca żylna choroba zakrzepowo-zatorowa: zbiorcza analiza dwóch badań obserwacyjnych. J Thromb Hemost. 2012;10:1004-1011.
17. Cosmi B, Filippini m, Campana F, et al; STEFLUX Czynniki ryzyka nawracających zdarzeń u pacjentów z zakrzepicą żył powierzchownych w randomizowanym badaniu klinicznym SteFlux (powierzchowna choroba zakrzepowo-zatorowa Fluxum). Thromb Res. 2014;133:196-202.
18. G orty s, Patton-Adkins J, DaLanno m, Starr J, Dean s, Satiani B. powierzchowna zakrzepica żylna kończyn dolnych: analiza czynników ryzyka, nawrotów i roli antykoagulacji. Vasc Med. 2004;9:1-6.
19. G illet JL, Allaert FA, Perrin M. powierzchowne zakrzepowe zapalenie żył w żylakach kończyn dolnych. Analiza prospektywna u 42 pacjentów . J Mal Vasc. 2004;29:263-272.
20. Martinelli I, Cattaneo M, Taioli E, De Stefano V, Chiusolo P, Mannucci PM. Genetyczne czynniki ryzyka zakrzepicy żył powierzchownych. Thromb Hemost. 1999;82:1215-1217.
21. Milio G, Siragusa S, Malato a, Grimaudo s, Pinto A. zakrzepica żył powierzchownych: rola dziedzicznego niedoboru naturalnych leków przeciwzakrzepowych w przedłużeniu żył głębokich. Int Angiol. 2009;28:298- 302.
22. Zollinger RW, Williams RD, Briggs DO. Problemy w diagnostyce i leczeniu zakrzepowego zapalenia żył. Arch Surg. 1962; 85: 34-40.
23. D ecous H; enoksaparyna Grupa Badawcza. Pilotażowe randomizowane, podwójnie ślepe porównanie heparyny o niskiej masie cząsteczkowej, niesteroidowego środka przeciwzapalnego i placebo w leczeniu zakrzepicy żył powierzchownych. Arch Int Med. 2003;163:1657-1663.
24. Prandoni P, Tormene D, Pesavento R; Vesalio Wysokie vs. niskie dawki heparyny o niskiej masie cząsteczkowej do leczenia zakrzepicy żył powierzchownych nóg: podwójnie ślepe, randomizowane badanie. J Thromb Hemost. 2005;3:1152-1157.
25. Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi a, Bucherini E; STEFLUX Randomizowane, podwójnie ślepe badanie heparyny niskocząsteczkowej (parnaparyny) w leczeniu zakrzepicy żył powierzchownych: STEFLUX (powierzchowna choroba zakrzepowo-zatorowa i Fluxum). J Thromb Hemost. 2012;10:1026-1035.
26. D ecousus H, Frappé P, Accassat s, et al. Epidemiologia, diagnostyka, leczenie i postępowanie w zakrzepicy żył powierzchownych kończyn dolnych. Best Pract Res Clin Haematol. 2012;25:275-284.
27. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ; American College of Chest Physicians. Terapia przeciwzakrzepowa w żylnej chorobie zakrzepowo-zatorowej: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Klatka piersiowa. 2008; 133 (suppl 6):454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; American College of Chest Physicians. Leczenie przeciwzakrzepowe w chorobie VTE: Antithromptic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Klatka piersiowa. 2012; 141 (suppl 2):e419S-e494S.
29. D i Nisio m, Wichers IM, Middeldorp S. leczenie powierzchownego zakrzepowego zapalenia żył nogi. Cochrane Database Syst Rev. 2013; 30; 4: CD004982.
30. D i Nisio m, Middeldorp S. leczenie powierzchownego zakrzepowego zapalenia żył kończyn dolnych. JAMA. 2014;311:729- 730.
31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Ligacja a antykoagulacja: leczenie powierzchownego zakrzepowego zapalenia żył powyżej kolana, nie obejmującego układu żył głębokich. J Am Coll. 2001;193: 556-562.
32. Lozano FS, Almazan A. heparyna o małej masie cząsteczkowej A rozłączenie saphenofemoralne w leczeniu zakrzepowego zapalenia żył powyżej kolana: badanie prospektywne. Vasc Endovascular Surg. 2003; 37: 415-420.
33. Chengelis DL, Bendick PJ,Glover JL, Brown OW, Ranval TJ. Postęp zakrzepicy żył powierzchownych do zakrzepicy żył głębokich. J Vasc 1996;24: 745-749.
34. Hingorani a, Ascher E. powierzchowne zakrzepowe zapalenie żył. Na: Głowiczki p., red. Podręcznik chorób żylnych. Wytyczne amerykańskiego Forum żylnego. 3.ed. London, UK: Hodder Arnold; 2009: 314-319.
Leave a Reply