NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Są one stosowane w produkcji aerozoli, środków porotwórczych do pianek i materiałów opakowaniowych, jako rozpuszczalniki i jako czynniki chłodnicze. CFC są klasyfikowane jako halowęglowodory, klasa związków zawierających atomy węgla i Atomy halogenów. Poszczególne cząsteczki CFC są oznaczone unikalnym systemem numeracji. Na przykład liczba CFC 11 oznacza liczbę atomów węgla, wodoru, fluoru i chloru (np. CCl3F jako CFC-11). Najlepszym sposobem zapamiętania systemu jest „zasada 90” lub dodanie 90 do liczby CFC, gdzie pierwsza cyfra to liczba atomów węgla (C), druga cyfra to liczba atomów wodoru (H), a trzecia cyfra to liczba atomów fluoru (F). Całkowitą liczbę atomów chloru(Cl) oblicza się za pomocą wyrażenia: Cl = 2 (C+1) – H-F. w przykładzie CFC-11 ma jeden węgiel, nie ma wodoru, jeden fluor, a zatem 3 atomy chloru.
lodówki pod koniec XIX wieku i na początku XX wieku używały toksycznych gazów, amoniaku (NH3), chlorku metylu (CH3Cl) i dwutlenku siarki (SO2) jako czynników chłodniczych. Po serii śmiertelnych wypadków w 1920 roku, kiedy chlorek metylu wyciekł z lodówek, poszukiwania mniej toksycznego zamiennika rozpoczęły się jako wspólny wysiłek trzech amerykańskich korporacji-Frigidaire, General Motors i Du Pont. CFC zostały po raz pierwszy zsyntetyzowane w 1928 roku przez Thomasa Midgleya Jr.z General Motors, jako bezpieczniejsze chemikalia do lodówek stosowanych w dużych aplikacjach komercyjnych1. 31 grudnia 1928 roku Frigidaire otrzymał pierwszy patent o numerze 1 886 339 na wzór CFC. W 1930 roku General Motors i Du Pont utworzyli Kinetic Chemical Company, która produkowała Freon (Nazwa handlowa Du Pont dla CFC) w dużych ilościach. Do 1935 roku Frigidaire i jego konkurenci sprzedali w Stanach Zjednoczonych 8 milionów nowych lodówek z użyciem freonu-12 (CFC-12) produkowanego przez Kinetic Chemical Company i te firmy, które otrzymały licencję na produkcję tego związku. W 1932 roku Carrier Engineering Corporation użyło freonu-11 (CFC-11) w pierwszej na świecie samodzielnej domowej klimatyzacji, zwanej „szafą atmosferyczną”.; Ze względu na rekord bezpieczeństwa CFC dla nietoksyczności, Freon stał się preferowanym chłodziwem w dużych systemach klimatyzacyjnych. Kodeksy Zdrowia Publicznego w wielu amerykańskich miastach zostały zmienione, aby wyznaczyć Freon jako jedyny płyn chłodzący, który może być stosowany w budynkach publicznych. Po ii Wojnie Światowej CFC były używane jako materiały pędne do sprayów na owady, farb, odżywek do włosów i innych produktów ochrony zdrowia. Pod koniec lat 50. i na początku lat 60. CFC umożliwiły niedrogie rozwiązanie potrzeby klimatyzacji w wielu samochodach, domach i budynkach biurowych. Później wzrost wykorzystania CFC rozpoczął się na całym świecie ze szczytową, roczną sprzedażą około miliarda dolarów (USA) i ponad milionem ton metrycznych wyprodukowanych CFC.
podczas gdy CFC są bezpieczne w większości zastosowań i są obojętne w dolnej atmosferze, przechodzą znaczącą reakcję w górnej atmosferze lub stratosferze. W 1974 roku dwaj chemicy z Uniwersytetu Kalifornijskiego, profesor F. Sherwood Rowland i Dr. Mario Molina wykazał, że CFC mogą być głównym źródłem nieorganicznego chloru w stratosferze po ich fotolitycznym rozkładzie przez promieniowanie UV. Ponadto część uwalnianego chloru mogłaby stać się aktywna w niszczeniu ozonu w stratosferie2. Ozon jest gazem śladowym zlokalizowanym głównie w stratosferze (patrz Ozon). Ozon pochłania szkodliwe promieniowanie ultrafioletowe o długości fali od 280 do 320 nm pasma UV-B, które może powodować uszkodzenia biologiczne u roślin i zwierząt. Utrata ozonu stratosferycznego skutkuje bardziej szkodliwym promieniowaniem UV-B docierającym do powierzchni Ziemi. Chlor uwalniany z CFC niszczy Ozon w reakcjach katalitycznych, w których 100 000 cząsteczek ozonu może zostać zniszczonych na atom chloru.
Duże wiosenne wyczerpanie ozonu stratosferycznego pogarszało się z każdym kolejnym rokiem. Ta utrata ozonu została opisana w 1985 roku przez brytyjskiego badacza Joe Farmana i jego kolegi3. Przez innych nazywana była „antarktyczną dziurą ozonową”. Dziura ozonowa była inna niż utrata ozonu w średnich szerokościach geograficznych. Straty były większe nad Antarktydą niż na średnich szerokościach geograficznych z powodu wielu czynników: niezwykle niskie temperatury regionu, dynamiczna izolacja tego obszaru oraz synergiczne reakcje chloru i brominy4. Utrata ozonu jest również zwiększona w regionach polarnych w wyniku reakcji z udziałem polarnych chmur stratosferycznych (PSCs)5 oraz w średnich szerokościach geograficznych po erupcjach wulkanicznych. Potrzeba kontrolowania CFC stała się pilna.
w 1987 r. 27 krajów podpisało globalny Traktat o ochronie środowiska, Protokół Montrealski w sprawie redukcji substancji zubożających warstwę Ozonową6, który przewidywał obniżenie poziomu produkcji tych związków w 1986 r.o 50% przed rokiem 2000. To międzynarodowe porozumienie zawierało ograniczenia w produkcji CFC-11, -12, -113, -114, -115, i halonów (chemikalia stosowane jako środki gaśnicze). Poprawka zatwierdzona w Londynie w 1990 roku była bardziej zdecydowana i wymagała likwidacji produkcji do roku 2000. Do poprawki londyńskiej dodano CHLOROWANE rozpuszczalniki, chloroform metylu (CH3CCl3) i tetrachlorek węgla (CCl4).
duże ilości reaktywnego chloru stratosferycznego w postaci tlenku chloru (ClO), które mogły powstać tylko w wyniku zniszczenia ozonu przez CFC w stratosferze, zostały zaobserwowane przez instrumenty na pokładzie samolotu NASA ER-2 i UARS (Upper Atmospheric Research Satellite) w niektórych regionach Ameryki Północnej podczas zimy 19927,8. Troska o środowisko dla CFC wynika z ich długiej żywotności w atmosferze (55 lat dla CFC-11 i 140 lat dla CFC-12, CCl2F2)9, co ogranicza naszą zdolność do zmniejszenia ich obfitości w atmosferze i związanej z tym przyszłej utraty ozonu. Zaowocowało to poprawką kopenhaską, która ograniczyła produkcję i została zatwierdzona później w 1992 roku. Produkcja tych chemikaliów zakończyła się w większości 1 stycznia 1996 roku. Jedynymi zatwierdzonymi wyjątkami były produkcja w krajach rozwijających się oraz niektóre wyłączone zastosowania w medycynie (np. inhalatory do astmy) i w badaniach. Protokół Montrealski zawierał przepisy wykonawcze poprzez stosowanie sankcji gospodarczych i handlowych w przypadku, gdy kraj sygnatariusz handluje lub produkuje te zakazane chemikalia. Obecnie Protokół Montrealski podpisało łącznie 148 państw-sygnatariuszy. Pomiary atmosferyczne CFC – 11 i CFC-12, zgłoszone w 1993 r., wykazały, że ich tempo wzrostu malało w wyniku zarówno dobrowolnego, jak i nakazanego zmniejszenia emisji9. Wiele CFC i wybranych chlorowanych rozpuszczalników wyrównało się (ryc. 1) lub zmniejszyło stężenie do 19949,10.
popyt na CFC został zaspokojony poprzez recykling i ponowne wykorzystanie istniejących zapasów CFC oraz zastosowanie substytutów. Niektóre zastosowania, na przykład odtłuszczanie metali i rozpuszczalniki czyszczące do płytek drukowanych, które kiedyś stosowały CFC, teraz używają płynów bezhalogenowych, wody (czasami jako pary) i rozcieńczonych kwasów cytrynowych. Przemysł opracował dwie klasy substytutów halowęglowodorów-wodorochlorofluorowęglowodory (HCFC) i wodorofluorowęglowodory (HFC). HCFC zawierają atomy wodoru oprócz chloru, fluoru i atomów węgla. Zaletą stosowania HCFC jest to, że wodór reaguje z hydroksylem troposferycznym (OH), co skutkuje krótszym czasem życia w atmosferze. HCFC-22 (CHClF2) ma żywotność atmosferyczną około 13 lat11 i był stosowany w klimatyzacji domowej o niskim zapotrzebowaniu i niektórych zastosowaniach chłodniczych od 1975 roku. Jednak HCFC nadal zawierają chlor, który umożliwia im niszczenie ozonu. Poprawka kopenhaska wzywa do wyeliminowania ich produkcji do roku 2030. HFC są uważane za jeden z najlepszych substytutów redukcji stratosferycznej utraty ozonu ze względu na ich krótką żywotność i brak chloru. W Stanach Zjednoczonych HFC-134a jest stosowany we wszystkich nowych domowych klimatyzatorach samochodowych. Na przykład HFC-134a gwałtownie rośnie w 1995 r.z szybkością wzrostu około 100% rocznie przy żywotności atmosfery około 12 lat12. („Zasada 90” ma również zastosowanie do wzoru chemicznego HCFC i HFC.)
stosowanie CFC, niektórych chlorowanych rozpuszczalników i halonów powinno stać się przestarzałe w następnej dekadzie, jeśli Protokół Montrealski będzie przestrzegany przez wszystkie strony i stosowane będą substytuty. Nauka, która stała się podstawą Protokołu Montrealskiego, zaowocowała Nagrodą Nobla w dziedzinie chemii w 1995 roku. Nagrodę otrzymali wspólnie profesorowie F. S. Rowland na Uniwersytecie Kalifornijskim w Irvine, M. Molina na Massachusetts Institute of Technology w Cambridge i Paul Crutzen Na Max-Planck-Institute for Chemistry w Moguncji, Niemcy, za pracę w chemii atmosfery, w szczególności dotyczącą tworzenia i rozkładu ozonu (w szczególności przez CFC i tlenki azotu).
1Midgley, T., and Henne, A., organic fluorides as refrigerants, Industrial and Engineering Chemistry, 22, 542-547, 1930.
2Molina, M. J., and F. S. Rowland, Stratospheric sink for chlorofluorometanes: Chlor atom catalyzed destruction of ozone, Nature, 249, 810-814, 1974.
3Farman, J. C., B. G. Gardiner, and J. D. Shanklin, Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction, Nature, 315,207-210, 1985.
4McElroy, M. B., R. J. Salawitch, S. C. Wofsy, and J. A. Logan, Reductions of Antarctic ozone due to synergistic interactions of chlor and bromine, Nature, 321, 759-762, 1986.
5Solomon, S., R. R. Garcia, F. S. Rowland, and D. J. wuebbles, On the depletion of Antarctic ozone, Nature, 321, 755-758, 1986.
6montreal Protocol on Substances that Deplete the Ozone Layer, 15 pp, United Nations Environmental Programme (UNEP), New York, 1987.
7Toohey, D. W., L. M. Avallone, L. R. Lait, P. A. Newman, M. R. Schoeberl, D. W. Fahey, E. L. Woodbridge, and J. G. Anderson, the seasonal evolution of reactive chlor in the northern hemisphere stratosphere, Science, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L. .Elson, D. Flower, R. Jarnot, and R. Harwood, Stratospheric ClO andozone from the Microwave Limb Sounder on the Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9elkins, J. W., T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher, and A. G. Raffo, Decrease in the growth rates of atmospheric chlorofluorocarbresses 11 and 12, Nature , 364, 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Huang, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley, and P. G. Simmonds, Atmospheric trends and lifetimes of CH3CCl3 and global OH concentrations, Science, 269, 187-192, 1995.
11Montzka, S. A., R. C. Myers, J. H. Butler, S. C. Cummings, and J. W. Elkins, Global tropospheric distribution and calibration scale of HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12montzka, S. A., R. C. Myers, J. H. Butler, J. W. Elkins, L. T. Lock, A. D. Clarke, and A. H. Goldstein, Observations of HFC-134a in the remote troposphere, Geophysical Research Letters, 23, 169-172, 1996.
sugerowane dodatkowe Czytanie:
Cagin, S., and P. Dray, Between Earth and Sky: How CFC changed our world and threatened the ozone layer, 512 pp., Pantheon Press, New York, 1993.
Scientific Assessment of Ozone Depletion: 1994, edited by D. L. Albritton, R. T. Watson, and R. J. Aucamp, 37, 451 pp., World Meteorological Organization (WMO), Genewa, 1995.
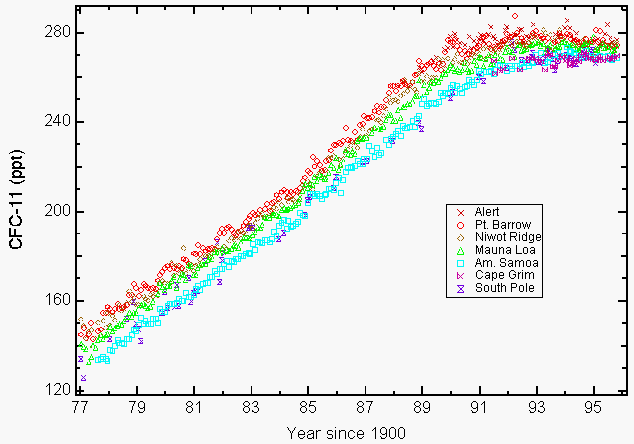
Rysunek 1: akumulacja chlorofluorowęglowodoru-11 (CFC-11) w atmosferze obniża się w wyniku dobrowolnej i nakazanej redukcji emisji. Średnia miesięczna podawana jako stosunek suchego mieszania w częściach na bilion (ppt) dla CFC-11 na poziomie gruntu dla czterech stacji NOAA/CMDL (pt. Barrow, Alaska; Mauna Loa, Hawaje; Cape Matatula, Samoa Amerykańskie I Biegun Południowy) i trzy współpracujące stacje (Alert, Terytoria Północno-Zachodnie, Kanada (Atmospheric Environment Service); Niwot Ridge, Kolorado (University of Colorado); Cape Grim Baseline Air Pollution Station, Tasmania, Australia, (Commonwealth Scientific and Industrial Research Organization)9. (Dzięki uprzejmości NOAA / CMDL)
Leave a Reply