kwas szczawiowy
Meera Senthilingam
w tym tygodniu udajemy się do Francji i odkrywamy związek, który wpłynął na zdrowie bardzo znanego dowódcy
Larsa Öhrströma
pierwszy września 1870 roku był ponurym dniem dla Charlesa Louisa Napoléona Bonaparte. W Sedan, małym francuskim miasteczku w pobliżu granicy belgijskiej, dowódca armii francuskiej Patrice de Mac-Mahon został ranny, a chory i słaby cesarz, lepiej znany jako Napoléon III, musiał poddać się i oddać się jako więzień niezłomnemu pruskiemu duetowi von Moltke i Bismarck. Tak więc wojna 1870 roku została przegrana, a bilans sił w Europie znacznie przechylił się na wschód, i wszyscy wiemy, jak to się skończyło.

źródło: ©
Sedan, Francja
czy to wszystko z powodu dużych krystalicznych złóż szczawianu wapnia, które powstały w nerkach Napoléona? Prawdopodobnie nie: wydaje się, że wojna została przegrana zaraz po jej ogłoszeniu Z powodu pruskiej wyższości technicznej i organizacyjnej.
jednak cesarz nie był zbyt chętny do podjęcia zbrojeń w pierwszej kolejności, z niektórymi jego doradcami głównymi wojownikami. Jak dobrze był w stanie im się oprzeć i przeciwdziałać, będąc nękanym przez bardzo bolesny stan znany jako kamienie nerkowe, trudno jest wiedzieć.
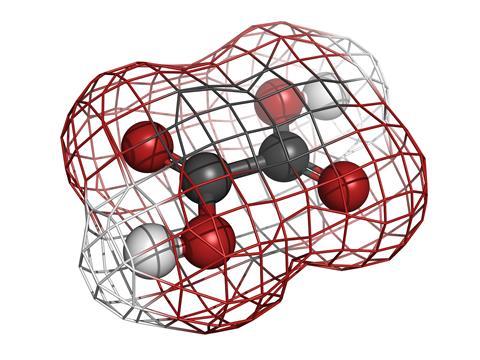
łatwiej jest zwrócić się do samych kamieni nerkowych, ponieważ są one podatne na szczegółowe metody badań naukowych, takie jak dyfrakcja rentgenowska. Są one tworzone przez dwa proste składniki, dodatnie jony wapnia, Ca2+ i ujemne jony szczawianu, dając związek dogodnie znany po prostu jako szczawian wapnia.
kwas szczawiowy jest tematem tego podcastu, a aniony szczawianowe są tym, co otrzymujesz, wraz z jonami H+, kiedy rozpuszczasz kryształy tego silnego kwasu w wodzie. Kwas szczawiowy jest małą cząsteczką o wzorze C2O4H2, ale być może jest lepiej reprezentowany jako HOOC-single-bond-COOH: tylko dwie grupy kwasów karboksylowych połączone ze sobą, aby uczynić go najprostszym organicznym di-kwasem. Być może znasz ten związek chemiczny jako związek, który sprawia, że rabarbar ma ten specjalny kwaśny tang do smaku,ale można go również znaleźć w szpinaku i wielu innych warzywach, które większość z nas chętnie je. Jest również częścią naszego normalnego metabolizmu i występuje całkowicie naturalnie w naszym ciele.
źródło: ©
nazwa pochodzi od rośliny, szczawiu drzewnego, małego zioła, którego liście mają wyraźny kwaśny smak, ożywiający, jeśli zgubisz się w lesie, i mający łacińską nazwę Oxalis acetosella.
najbardziej charakterystyczną cechą tej małej cząsteczki jest jej kształt. Wygląda trochę jak dwa ” Y ” połączone przez nakładanie się ich baz. Atomy węgla znajdują się na dwóch skrzyżowaniach, a atomy tlenu na czterech końcach z protonami (lub jonami H+) wiszącymi jeden po drugim na każdym z tych atomów tlenu. Co więcej, jest całkowicie płaski i kiedy traci protony, aby stać się anionem szczawianowym, ma ładunki minus zlokalizowane na dwóch atomach tlenu.
większość zastosowań technicznych kwasu szczawiowego opiera się na jego płaskości i ładunku ujemnym, podobnie jak problemy z nerkami Napoléona. W przededniu bitwy pod Sedanem von Moltke skutecznie zaatakował armię francuską klasycznym ruchem szczypiec, atakując z dwóch stron, a nie w centrum. W ten sam sposób, jony szczawianowe mają dwie pary elektronów na każdym z ujemnych atomów tlenu, które łatwo atakują z dwóch stron każdy jon metalu, który stanie mu na drodze. I tak jak w Sedanie, będzie więcej jonów szczawianu, otaczając metal dwoma, trzema lub czterema jonami szczawianu w zależności od jego wielkości.
efekt ten można wykorzystać do usuwania niepożądanych związków żelaza, zwłaszcza rdzy, z naczyń kuchennych, a nawet marmuru. Jako zmiatacze, kwas szczawiowy lub szczawiany są składnikami wielu preparatów do czyszczenia technicznego, a wszystkie te roztwory działają przy założeniu, że utworzone związki Metal-szczawian są rozpuszczalne w wodzie, a zatem można je łatwo zmyć.

źródło: ©
nie tak. Dodatnie jony wapnia naprawdę kochają bardziej ujemne szczawianowe atomy tlenu i do tego stopnia, że nie dbają o to, czy szczawianowe atomy tlenu mają ładunek ujemny, czy nie. Więc nie tylko będzie ruch cęgów do przodu w kierunku jednego jonu wapnia, ale także do tyłu, przyłączając się do drugiego w tym kierunku. Ponieważ każdy jon wapnia jest dość duży, cztery jony szczawianu będą się gromadzić wokół każdego jonu metalu (w porównaniu z trzema dla żelaza), każdy przyłączając się do dwóch innych jonów wapnia w innym kierunku. W ten sposób szczawian wapnia rozwinie się w nieskończoną sieć, która będzie całkowicie nierozpuszczalna w wodzie. Ponieważ coraz więcej jonów wapnia i jonów szczawianu przechodzi przez nerki, kryształy będą rosły, aż stan stanie się dość bolesny.
ale nie obawiaj się, poza pewnymi wyjątkowymi schorzeniami, normalne, a nawet wysokie spożycie jonów wapnia i kwasu szczawiowego ze źródeł naturalnych nie wydaje się zwiększać ryzyka kamicy nerkowej.
nierozpuszczalność szczawianów znajduje również zastosowanie w technologii. Pierwiastki ziem rzadkich, czyli lantanoidy, stają się coraz ważniejsze w wielu zastosowaniach technicznych. Często pierwszym etapem ich przetwarzania i rafinacji, po początkowym wymywaniu z rud, jest wytrącanie tych pierwiastków jako ich szczawianów, ponieważ podobnie jak w przypadku szczawianu wapnia są one bardzo nierozpuszczalne.
oprócz niefortunnego spotkania ze szczawianem wapnia, Napoléon III jest znany w historii chemii jako inicjator rozwoju margaryny i forsowania niedrogiej i praktycznej metody wytwarzania aluminium na skalę przemysłową, w jego czasach najdroższego ze wszystkich metali. Nie widział osiągnięcia tego późniejszego celu, ale warto zauważyć, że substancja chemiczna, która dała mu tyle bólu, kwas szczawiowy, jest również używana do wytwarzania i barwienia twardej, odpornej na ścieranie i korozję warstwy tlenkowej – znanej również jako powłoka anodowana, która jest teraz tak ważna w wielu naszych zastosowaniach aluminium.
Meera Senthilingam
więc zdrowie i Przemysł połączyły się. To był Lars Öhrström z Chalmers Tekniska Högskola w Szwecji, który przedstawił wyniszczającą chemię kwasu szczawiowego w nerkach. W przyszłym tygodniu Lars wraca ze składem zdolnym do obrony.
Lars Öhrström
nie jest jasne, kiedy ferrocen został po raz pierwszy wyprodukowany, ale wydaje się, że został on zarejestrowany jako „żółty szlam” pod koniec lat 40.przez techników procesowych kontrolujących rury w rozdrabniaczu Union Carbide, który był używany do produkcji małego cyklopentadienu węglowodorowego z dicyklopentadienu.
wywołało to spore zamieszanie, ponieważ wcześniej nie znano stabilnej cząsteczki złożonej tylko z węglowodorów i metalu przejściowego, a związek ten mógł być przechowywany w powietrzu w temperaturze pokojowej bez samozapłonu. Przetrwał również spotkanie z tak notorycznymi zabójcami cząsteczek metaloorganicznych, jak woda, kwasy czy zasady.
Meera Senthilingam
i odkryj chemię umożliwiającą to w przyszłym tygodniu chemii w swoim pierwiastku. Do tego czasu dziękuję za wysłuchanie, jestem Meera Senthilingam
Leave a Reply