Explainer: co to jest izotop?
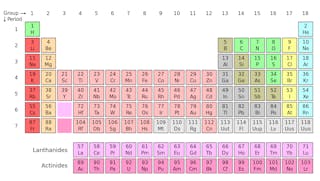
Jeśli kiedykolwiek badałeś układ okresowy pierwiastków (patrz poniżej), prawdopodobnie już wiesz, że ta tabela ujawnia wiele na temat właściwości chemicznych atomów tworzących nasz świat.
ale możesz nie zdawać sobie sprawy, że każdy kwadrat układu okresowego faktycznie reprezentuje rodzinę izotopów — atomów, które mają tę samą nazwę i właściwości chemiczne, ale mają różne masy.
aby zrozumieć, czym są izotopy i jak możemy je wykorzystać, musimy przyjrzeć się bliżej wnętrzu atomu.
budulec materii
ATOM składa się z niezwykle gęstego jądra (zwanego jądrem) protonów i neutronów, otoczonego rozproszoną chmurą elektronów.
możesz myśleć o protonach i neutronach jako o tym samym rodzaju cząstki z jedną kluczową różnicą: protony są naładowane dodatnio, podczas gdy neutrony nie mają ładunku. Oznacza to, że protony mogą „czuć” pole elektryczne lub magnetyczne, podczas gdy neutrony nie.
elektrony, które są znacznie lżejsze od protonów lub neutronów, mają taką samą wielkość ładunku jak proton, ale mają przeciwny znak, co oznacza, że każdy atom, który ma taką samą liczbę protonów i elektronów, jest elektrycznie neutralny.
to elektrony decydują o chemicznym zachowaniu danego pierwiastka.

izotopy pierwiastka mają tę samą liczbę protonów, ale mają inną liczbę neutronów. Użyjmy węgla jako przykładu.
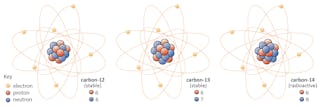
w naturze występują trzy izotopy węgla – węgiel-12, węgiel-13 i węgiel-14. Wszystkie trzy mają sześć protonów, ale ich liczby neutronowe – odpowiednio 6, 7 i 8-różnią się. Oznacza to, że wszystkie trzy izotopy mają różne masy atomowe (najcięższy jest węgiel-14), ale mają tę samą liczbę atomową (z=6).
chemicznie wszystkie trzy są nie do odróżnienia, ponieważ liczba elektronów w każdym z tych trzech izotopów jest taka sama.
więc różne izotopy tego samego pierwiastka są identyczne chemicznie. Ale niektóre izotopy mają zdolność obejścia tej reguły przez całkowite przekształcenie się w inny pierwiastek.
marsz w kierunku stabilności
ta transformacyjna zdolność niektórych izotopów ma związek z faktem, że nie wszystkie izotopy są stabilne, i to właśnie doprowadziło Fredericka Soddy ’ ego do jego nagrodzonego Nagrodą Nobla odkrycia izotopów w 1913 roku.
niektóre izotopy – takie jak węgiel-12 – będą szczęśliwie nadal istnieć jako węgiel, chyba że wydarzy się coś niezwykłego. Inne-powiedzmy węgiel-14-w pewnym momencie rozpadnie się w stabilny izotop w pobliżu.
w tym przypadku jeden z neutronów w węglu-14 zamienia się w proton, tworząc azot-14. Podczas tego procesu, który jest znany jako rozpad beta, jądro emituje promieniowanie w postaci elektronu i antyneutrino.
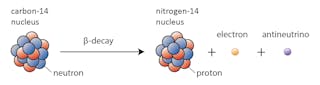
istnieje wiele czynników, które mogą spowodować rozpad jądra. Jednym z najważniejszych jest stosunek protonów do neutronów w danym jądrze. Jeśli jądro ma zbyt wiele neutronów (definicja „zbyt wielu” zależy od ciężaru jądra), istnieje szansa, że rozpadnie się w kierunku stabilności.
to samo ma miejsce, gdy jądro ma zbyt wiele protonów. Jest to jeden z powodĂłw dla ktĂłrych niektĂłre izotopy danego pierwiastka sÄ … radioaktywne, podczas gdy inne nie.
z brzuchów gwiazd
już pewnie zastanawiacie się, jak powstały te wszystkie izotopy. Jak się okazuje, to pytanie jest złożone, ale nadaje trochę prawdy powiedzeniu, że wszyscy jesteśmy stworzeni z gwiezdnego pyłu.
niektóre z lżejszych izotopów powstały bardzo wcześnie w historii wszechświata, podczas Wielkiego Wybuchu. Inne wynikają z procesów zachodzących w gwiazdach lub w wyniku przypadkowych zderzeń wysokoenergetycznych jąder – znanych jako promienie kosmiczne-w naszej atmosferze.
Większość naturalnie istniejących izotopów jest końcowym (stabilnym lub długotrwałym) produktem powstałym w wyniku długiej serii reakcji jądrowych i rozpadów.
w większości tych przypadków lekkie jądra musiały się rozbić z wystarczającą energią, aby umożliwić silne siły – Wiązanie podobne do kleju, które tworzy się, gdy protony i neutrony zbliżają się wystarczająco blisko, aby się dotknąć-aby pokonać siłę elektromagnetyczną – która odpycha protony od siebie. Jeśli silna siła zwycięży, zderzające się jądra wiążą się ze sobą lub łączą, tworząc cięższe jądro.
nasze słońce jest tego dobrym przykładem. Jednym z jego głównych źródeł energii jest szereg reakcji termojądrowych i procesów rozpadu beta, które przekształcają wodór w hel.

przekształcanie wiedzy w narzędzia
od początku XX wieku, kiedy istnienie izotopów zostało po raz pierwszy zrealizowane, fizycy jądrowi i chemicy szukali sposobów na zbadanie, w jaki sposób można tworzyć izotopy, jak się rozpadają i jak możemy je wykorzystać.
jak się okazuje, charakter izotopów – ich jednorodność chemiczna, odrębność jądrowa – sprawia, że są one przydatne w szerokim zakresie zastosowań w tak różnorodnych dziedzinach, jak medycyna, Archeologia, Rolnictwo, Energetyka i górnictwo.
Jeśli kiedykolwiek miałeś tomografię PET, skorzystałeś z produktu ubocznego rozpadu radioaktywnego niektórych izotopów (często nazywanych izotopami medycznymi). Produkujemy te medyczne izotopy wykorzystując naszą wiedzę na temat przebiegu reakcji jądrowych, przy pomocy reaktorów jądrowych lub akceleratorów zwanych cyklotronami.
ale znaleźliśmy również sposoby na wykorzystanie naturalnie występujących izotopów promieniotwórczych. Datowanie węglowe, na przykład, wykorzystuje długotrwały izotop węgla-14 do określenia, jak Stare są obiekty.
w normalnych warunkach węgiel-14 jest wytwarzany w naszej atmosferze w wyniku reakcji promieniowania kosmicznego z azotem-14. Jego okres półtrwania wynosi około 5700 lat, co oznacza, że połowa ilości węgla-14 rozpadnie się w tym okresie.

podczas gdy organizm biologiczny żyje, przyjmuje około jednego izotopu węgla-14 na każdy bilion stabilnych izotopów węgla-12, a stosunek węgla-12 do węgla-14 pozostaje taki sam, gdy organizm żyje. Gdy umiera, nowy pobór węgla zatrzymuje się.
oznacza to stosunek węgla-14 do węgla-12 zmian w szczątkach tego organizmu w czasie.
Jeśli wyodrębnimy węgiel metodami chemicznymi z próbki, możemy zastosować metodę zwaną spektrometrią mas akceleratora (AMS), aby oddzielić poszczególne izotopy węgla wagowo.
AMS wykorzystuje fakt, że przyspieszone cząstki o tym samym ładunku, ale o różnych masach podążają oddzielnymi ścieżkami przez pola magnetyczne. Korzystając z tych oddzielnych ścieżek, możemy z niewiarygodną dokładnością określić stosunek izotopów.
jak widać z tych przykładów, naszą wiedzę o izotopach stosujemy na wiele sposobów. Produkujemy je, wykrywamy, wydobywamy i badamy w podwójnym celu, aby zrozumieć, dlaczego jądro atomowe zachowuje się tak, jak działa i jak możemy wykorzystać jego moc dla naszej korzyści.
Leave a Reply