Epigenetyka-nie tylko geny czynią nas
więc czym jest epigenetyka?
inny sposób patrzenia na epigenetykę jest taki: podczas gdy tradycyjna genetyka opisuje sposób, w jaki sekwencje DNA w naszych genach są przekazywane z jednego pokolenia na drugie, epigenetyka opisuje sposób, w jaki geny są używane. Aby zrobić analogię komputerową, pomyśl o epigenetyce jako metadanych, informacji opisującej i porządkującej podstawowe dane. Jeśli na przykład posiadasz Odtwarzacz MP3, będzie on zawierał wiele danych, plików MP3. Pomyśl o nich jak o genach. Ale prawdopodobnie będziesz mieć również playlisty lub możesz odtwarzać utwory według artysty lub gatunku. Te informacje, Lista odtwarzania, artysta, gatunek itp. to metadane. Określa, które utwory są odtwarzane i w jakiej kolejności, i tym jest epigenetyka dla genetyki. Jest to zestaw procesów, które wpływają na to, że geny są włączane lub „wyrażane”, jak powiedzieliby biolodzy molekularni.
Jak działa epigenetyka?
więc epigenetyka dotyczy sposobu ekspresji i wykorzystania genów, a nie sekwencji DNA samych genów, ale jak to działa? Wielu badaczy studiuje epigenetykę w ciągu ostatnich kilku dekad i jest to obecnie obszar intensywnej działalności badawczej. Wiemy, że częścią działania epigenetyki jest dodawanie i usuwanie małych znaczników chemicznych do DNA. Możesz myśleć o tych tagach jako notatkach post-it, które podkreślają poszczególne geny z informacją o tym, czy powinny być włączone, czy wyłączone. W rzeczywistości znacznik chemiczny, o którym mowa, nazywa się grupą metylową (Patrz Diagram 1) i jest używany do modyfikacji jednej z czterech zasad lub” liter chemicznych”, A, C, T I G, które tworzą kod genetyczny naszego DNA. Litera oznaczona jest C lub cytozyną, a gdy jest modyfikowana lub metylowana, nazywana jest 5-metylo-cytozyną. Grupy metylowe są dodawane do DNA przez enzymy zwane transferazami metylowymi DNA (DNMTs).
-
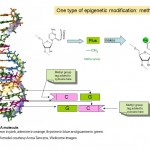
Dwa znaczniki chemiczne, grupy metylowe i acetylowe, które są centralne dla zjawisk epigenetycznych i struktury chemicznej cytozyny i 5-metylo-cytozyny w DNA. Pięciokątna część cząsteczki tworzy ciągły „szkielet” DNA . Pokazano tylko jedną z dwóch nici DNA, które tworzą znaną podwójną helisę.
Status królowej pszczół jest częściowo określony przez mniejszą liczbę znaczników metylowych
w większości przypadków więcej metylowanego Cs w DNA genu powoduje wyłączenie genu. Pszczoły miodne dają nam dobry przykład na to, jak to może działać. Pszczoły robotnice i królowa mają bardzo różne ciała; królowa jest znacznie większa, dłużej żyjąca, ma powiększony brzuch i składa wiele tysięcy jaj, podczas gdy mniejsze robotnice są sterylne, ale mają złożone umiejętności żerowania i komunikacji. Mimo to królowa i robotnice w ulu są samicami i genetycznie identycznymi. Wskazówka, Jak to się dzieje, leży w mleczku pszczelym, wydzielinie, która jest karmiona niektórymi rozwijającymi się larwami, co powoduje, że larwy stają się królowymi, a nie robotnikami. Wrócimy do mleczka pszczelego i jego właściwości wytwarzania królowej później, ale fascynujące badania wykazały, że jeśli ilość grupy metylowej dodającej enzym DNMT została sztucznie zmniejszona w larwach pszczół, larwy rozwinęły się w królowe, nawet jeśli nie były karmione mleczkiem pszczelym. Tak więc, przełączanie między królową a robotnikiem może być odwrócone przez obfitość znaczników metylowych na DNA larw pszczół. Mniej znaczników metylowych prowadzi do włączania specjalnego genu lub genów w rozwijających się larwach, co powoduje rozwój larw w królowe, a nie robotnice.
Tagi na ogonach działają również przełączniki genów
tagi metylowe DNA są jednak tylko jedną częścią historii. W komórkach wszystkich roślin i zwierząt DNA jest pakowane lub zawijane w nukleosomy, gdzie podwójna helisa DNA jest owinięta wokół centralnego rdzenia białka (Patrz Diagram 2). Około 150 liter DNA (lub par zasad) jest owinięte wokół każdego nukleosomu, co pomaga zapakować 3 miliardy par zasad kodu genetycznego do każdej z naszych komórek. Nukleosomy są zbyt małe, aby je zobaczyć przy użyciu konwencjonalnych mikroskopów, ale biolodzy używają techniki zwanej dyfrakcją rentgenowską do opracowania kształtu i organizacji obiektów takich jak nukleosomy, a w 1997 technika ta ujawniła piękną strukturę nukleosomów w wysokiej rozdzielczości-patrz (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
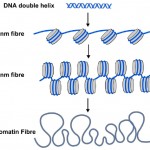
Znana podwójna helisa DNA (niebieska) owinięta jest wokół nukleosomów (szarych cylindrów) w komórkach. Łańcuch nukleosomów może być zwinięty w grubsze włókno, zwane włóknem 30 nm, a to może być dalej zwinięte w jeszcze grubsze włókno chromatyny. Kiedy geny są włączane, ich nukleosomy są bardziej niepowlekane, jak włókno 10 Nm.
Nukleosomy są zwarte, ale końce lub „ogony” białek tworzących nukleosom, które są nazywane histonami, odstają od zwartej struktury nukleosomu. Podobnie jak znaczniki metylowe na DNA, małe znaczniki chemiczne mogą być również dodawane do tych ogonów histonowych (Patrz Diagram 3). Dwa znaczniki chemiczne, które są dodawane do tych ogonów są grupy acetylowe i grupy metylowe. Metyl, acetyl i kilka innych rodzajów tagów mogą być dodawane do ogonów w dużej liczbie kombinacji, a to wpływa na to, czy Gen bazowy jest włączony, czy wyłączony. W rzeczywistości geny mogą być wyłączane od razu (nazywa się to wyciszaniem), pełne lub gdzieś pomiędzy za pomocą tagów metylowych DNA i tagów ogonowych histonów. Połączenie znaczników DNA i histonu może również wpływać na to, jak łatwo gen jest włączany lub wyłączany.
-
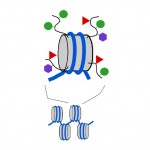
Znaczniki chemiczne mogą być dodawane do „ogonów” białek histonowych tworzących nukleosomy. Szary cylinder, nukleosom; zakrzywione czarne linie, ogony histonowe; zielone koła, znaczniki metylowe; czerwone trójkąty, znaczniki acetylowe; mauve sześciokąty, inne rodzaje znaczników.
gdy komórki dzielą się
gdy komórki dzielą się, cała sekwencja DNA z oryginalnej komórki (3 miliardy par zasad zawartych w 23 parach chromosomów w ludzkiej komórce) jest powielana tak, że obie komórki potomne otrzymują dokładną kopię. Co się dzieje z tymi wszystkimi znacznikami epigenetycznymi? Od jakiegoś czasu wiemy, że znaczniki DNA-metylowe również są kopiowane, tak że obie komórki potomne mają ten sam wzór metylacji DNA. Obecnie wiemy, że wzorzec znaczników histonowych jest również w większości powielany w miarę dzielenia się komórek, chociaż jest to obecnie mniej zrozumiałe. Niemniej jednak podział komórek jest również czasem, w którym znaczniki epigenetyczne najłatwiej można zmienić.
powrót długowiecznego robaka
na samym początku natknęliśmy się na historię długowiecznych mikroskopijnych robaków, które przekazywały swoją długowieczność potomstwu, nawet jeśli pojedyncze potomstwo nie odziedziczyło wariantu genu (mutacji), który pierwotnie spowodował wydłużenie życia. Jesteśmy teraz w stanie wyjaśnić ten pozornie dziwny wynik. W większości przypadków geny zawierają informacje, aby cząsteczka białka, a cząsteczki białka mogą być enzymami, które przeprowadzają reakcje chemiczne w komórce, lub części struktury samej komórki. Okazuje się, że geny zmutowane w badaniu robaków tworzą białka, które współpracują ze sobą, aby dodać tag metylowy do nukleosomów. Ten znacznik jest włącznikiem. Gdy jeden lub więcej genów zostało zmutowanych, ten znacznik był nieobecny, a kilka genów, które powinny być włączone, w tym niektóre zaangażowane w starzenie się, zostało wyłączonych, a robaki miały dłuższą żywotność. Nieoczekiwaną rzeczą jest to, że uważa się, że znaczniki epigenetyczne zostały całkowicie usunięte lub zresetowane podczas tworzenia plemników i komórek jajowych, więc w przeciwieństwie do samych genów nie powinny być przekazywane następnym pokoleniom. Ale ten wynik i inne badania, które pokazują, że nie zawsze tak jest i że czasami wzór znaczników epigenetycznych jest przekazywany dalej.
Jak zrobić królową
czy larwalna pszczoła miodna staje się robotnicą, czy królową, zależy od przełącznika epigenetycznego, a ten przełącznik wydaje się być „odwrócony” przez mleczko pszczele. Ale co jest takiego w mleczku pszczelym, który prowadzi larwę, która w przeciwnym razie wyrosłaby na robotnika, by stać się królową? Odpowiedź polega na zrozumieniu, że poszczególne znaczniki chemiczne, które są dodawane do ogonów histonowych nukleosomów, są stale zmieniane przez komórkę. Znaczniki acetylowe są dodawane przez enzymy zwane histonowymi transferazami acetylowymi i są usuwane lub kasowane przez drugą grupę enzymów zwanych deacetylazami histonowymi (HDACs). Oba te enzymy są obecne w większości komórek, co pozwala na włączanie lub wyłączanie genów w czasie.
Więcej znaczników acetyl pomaga zapewnić status królowej pszczół
ostatnio naukowcy postanowili zidentyfikować związki w mleczku pszczelym, które mogłyby zmienić ten proces, a to, co odkryli, było czymś znanym jako inhibitor HDAC. Był to stosunkowo prosty związek chemiczny obecny w mleczku pszczelym, który zatrzymuje działanie enzymów HDAC, które normalnie usuwają znaczniki acetylowe z histonów. Powoduje to nagromadzenie znaczników acetylowych w komórkach zarodków pszczół i podobnie jak redukcja opisanych wcześniej grup DNA-metylowych, uważa się, że włącza ona kluczowe geny wymagane do rozwoju królowej. Bez inhibitora HDAC w mleczku pszczelym, larwy postępują zgodnie z „domyślnym” zestawem instrukcji genetycznych i rozwijają się w pracowników.
inhibitory HDAC są ważne nie tylko dla matek pszczół, ale są również częścią niewielkiej, ale rosnącej liczby leków użytecznych medycznie, które są ukierunkowane na znaczniki epigenetyczne i które są przydatne w leczeniu niektórych rodzajów raka. Ponadto Hdac odgrywają również rolę w sposobie, w jaki nasze mózgi tworzą wspomnienia, a nowe leki wpływające na acetylację histonów mogą w przyszłości odgrywać rolę w leczeniu zaburzeń pamięci u pacjentów w podeszłym wieku.
środowisko i epigenetyka
widzieliśmy, jak różnica między królową a pszczołą robotnicą jest określana przez narażenie na działanie substancji chemicznej, która bezpośrednio zmienia znaczniki epigenetyczne, takie jak grupy acetylowe; ale czy są przykłady, w których odżywianie lub inne aspekty środowiska wpływają na populacje ludzkie w sposób, który można wyjaśnić epigenetyką? Oczywiście nie możemy przeprowadzać eksperymentów na ludzkich populacjach, jak na mikroskopijnych robakach czy pszczołach, ale czasami dzieje ludzkości lub zjawiska naturalne robią to za nas. Jednym z takich przykładów jest tzw. holenderska Zima głodowa. W ostatnim roku ii Wojny Światowej w Europie embargo na żywność nałożone przez okupacyjne siły niemieckie na ludność cywilną Holandii spowodowało silny głód, zbiegający się ze szczególnie surową zimą. Około 20 000 osób zmarło z głodu, ponieważ racje żywnościowe spadły do poniżej 1000 kilokalorii dziennie. Pomimo chaosu wojny, opieka medyczna i dokumentacja pozostały nienaruszone, umożliwiając naukowcom późniejsze badanie wpływu głodu na ludzkie zdrowie. Okazało się, że dzieci, które były w łonie matki podczas głodu, doświadczyły przez całe życie wzrostu ich szans na rozwój różnych problemów zdrowotnych w porównaniu do dzieci poczętych po głodzie. Najbardziej wrażliwym okresem dla tego efektu były pierwsze kilka miesięcy ciąży. Tak więc wydaje się, że coś dzieje się na wczesnym etapie rozwoju w łonie matki, które mogą wpływać na jednostkę do końca życia.
efekty epigenetyczne mogą czasami przejść na wnuki
jeszcze bardziej zaskakujące, niektóre dane wydają się sugerować, że wnuki kobiet, które były w ciąży podczas zimy głodowej doświadczają niektórych z tych efektów. Z tego, co już omówiliśmy, zdecydowanie sugeruje to mechanizm epigenetyczny. W rzeczywistości badania z holenderskimi rodzinami zimy głodowej trwają, a ostatnie badania dotyczące genu igf2 wykazały niższe poziomy znacznika metylowego w DNA tego genu u osób narażonych na głód przed urodzeniem. Chociaż IGF2 może nie być sam w sobie zaangażowany w zwiększone ryzyko złego stanu zdrowia u tych osób, pokazuje, że efekty epigenetyczne (tj. zmniejszenie liczby znaczników metylowych na poszczególnych genach), które są produkowane przed urodzeniem, mogą trwać przez wiele dziesięcioleci. Badania na zwierzętach wykazały również, że dieta matki może mieć wpływ na jej potomstwo. Na przykład, karmienie owiec dietą pozbawioną rodzajów żywności wymaganych do tworzenia grup metylowych prowadzi do potomstwa ze zmienionymi wzorcami metylacji DNA i które mają wyższe niż oczekiwano wskaźniki niektórych problemów zdrowotnych.
epigenetyka i imprinting, dlaczego geny od mamy i taty nie zawsze są równoważne
wszyscy mamy 23 pary chromosomów w naszych komórkach. Dla każdej pary, jeden pochodziło od matki, a jeden od ojca. Tak więc dziedziczymy po jednej kopii każdego genu od każdego rodzica i ogólnie Zakładamy, że funkcja genu nie zależy od tego, od którego rodzica pochodzi. Jednak w przypadku nadrukowanych genów wszystko jest inne. W przypadku tych genów aktywna jest zarówno matczyna, jak i ojcowska kopia genu, podczas gdy druga jest milcząca. Istnieje co najmniej 80 nadrukowanych genów u ludzi i myszy, z których wiele jest zaangażowanych w wzrost zarodka lub łożyska. Jak można wyłączyć jedną kopię genu, podczas gdy druga kopia w tej samej komórce jest włączona? Odpowiedzią jest epigenetyka. Prawdopodobnie najbardziej badany gen jest igf2(patrz wyżej). Jedna część IGF2 działa jako przełącznik. Jeśli dna jest metylowane tutaj Gen IGF2 może być wyrażona. Przełącznik jest metylowany tylko w kopii genu taty i tak tylko ta kopia jest wyrażana, podczas gdy kopia matczyna jest milcząca. Uważa się, że ten przełącznik jest ustawiony w gametach (jajkach i plemnikach), więc od samego początku geny otrzymane od mamy i te od taty są inaczej oznaczone tagami epigenetycznymi, więc nie są równoważne.
Imprinting i zaburzenia psychiczne
zespoły Angelmanna i Pradera-Williego to dwa odrębne uwarunkowania genetyczne o różnych objawach, oba spowodowane utratą części chromosomu 15. Dzieci, które odziedziczą jedną kopię tego wadliwego chromosomu, rozwijają zespół Angelmanna lub Pradera-Williego, pomimo posiadania normalnej kopii chromosomu od drugiego rodzica. Jak więc ta sama mutacja (utrata części chromosomu 15) prowadzi do tych dwóch różnych stanów? Odpowiedź leży w odkryciu, że ten konkretny fragment chromosomu 15 zawiera wiele genów, które są odciśnięte, więc tylko ojcowska lub matczyna Kopia tych genów są wyrażane; który z dwóch zespołów pojawia się zależy od tego, czy delecja była w odziedziczonym przez matkę lub ojca chromosomie. Gdy wadliwy chromosom jest dziedziczony po tacie, nie ma funkcjonalnej kopii odciśniętych genów, które są wyłączone na chromosomie 15 matki, a wynikiem jest zespół Angelmanna i odwrotnie dla zespołu Pradera-Williego. Jest to zupełnie niepodobne do większości warunków genetycznych, takich jak mukowiscydoza, gdzie wpływ na rozwój lub zdrowie jest widoczny tylko wtedy, gdy zmutowany gen lub geny są dziedziczone od obojga rodziców.
Chłopcy kontra dziewczyny, jak wyłączyć cały chromosom
odrobina genetyki, o której większość z nas wie, czyni chłopca chłopcem, a dziewczynę dziewczynką. To chromosomy X i Y. Na samym początku naszej egzystencji każda z nas otrzymała jeden chromosom X od mamy poprzez jajko, a podczas gdy dziewczynki otrzymały inny chromosom X od swoich ojców, poprzez spermę, chłopcy otrzymali chromosom Y. Chromosom Y w komórkach męskiego zarodka kieruje go do rozwoju w chłopca, podczas gdy z dwoma chromosomami X i brakiem chromosomu Y żeński zarodek rozwija się w dziewczynę. Możecie zauważyć, że jest tu nierównowaga. Każdy z pozostałych chromosomów ma po dwa, ale w przypadku chromosomów płciowych (X i Y) dziewczynki mają dwa chromosomy X, podczas gdy chłopcy mają tylko jeden x (I Y). Podczas gdy chromosom Y zawiera kilka genów, głównie zaangażowanych w „męskość”, chromosom X zawiera sporo genów zaangażowanych w ważne procesy, takie jak widzenie kolorów, krzepnięcie krwi i funkcjonowanie mięśni. Aby wyrównać „dawkę” genów chromosomu X pomiędzy komórkami męskimi i żeńskimi, jeden cały chromosom X jest wyłączany w komórkach żeńskich. To się nazywa inaktywacja chromosomu X i dzieje się bardzo wcześnie w łonie matki. W tym procesie komórki losowo wyłączają albo ojcowski lub matczyny chromosom X, tak, że gdy dziewczynka rodzi się jej ciało jest mieszaniną lub chimerą komórek, w których albo matczyny lub ojcowski chromosom X jest wyłączony. Sposób, w jaki to się dzieje, obejmuje rodzaj znaczników epigenetycznych, o których rozmawialiśmy i od dziesięcioleci wiadomo, że żeńskie komórki zawierają jeden bardzo zwarty chromosom X, zwany ciałem Barra, który można zobaczyć pod mikroskopem, a jest to nieaktywny chromosom X.
przypadek kota szylkretowego
prawdopodobnie wszyscy znamy koty szylkretowe i ich cętkowane płaszcze z łatami pomarańczowego i czarnego futra. Co może nie wiedzieć, jest to, że prawie wszystkie koty z tego typu sierści są samicy! Powodem tego jest fakt, że Gen koloru sierści znajduje się na chromosomie X kota. Istnieją dwie wersje tego genu, zwane ” O ” I „o”; jedna daje Rude futro, a druga Czarne. Dwie kopie tej samej wersji u samicy kota dają odpowiednio Rude lub czarne futro, ale jedna kopia każdej daje efekt szylkretowy. Chodzi o inaktywację chromosomu X. Skóra tych kotów składa się z plastrów komórek, w których inaktywowany jest chromosom X matki lub ojca. Powoduje to, że skóra z włączonym genem O i wyciszonym w niektórych plastrach (futro pomarańczowe) i włączonym genem o i wyciszonym w innych plastrach (futro Czarne), stąd wzór szylkretowy. Ponieważ samce mają tylko jeden chromosom X i brak inaktywacji chromosomu X, są pomarańczowe lub czarne na całej powierzchni.
dziedziczenie epigenetyczne, czy stany epigenetyczne mogą być przekazywane z pokolenia na pokolenie?
jak widzieliśmy na przykładzie glisty, efekty epigenetyczne (w tym przypadku przedłużona żywotność) mogą być czasami przekazywane z jednego pokolenia na drugie, chociaż efekty wydają się trwać tylko kilka pokoleń. Czy istnieją przykłady, w których efekty epigenetyczne przenoszą się na kolejne pokolenia u ludzi lub innych ssaków? Istnieją pewne dowody na to, że skutki holenderskiej zimy głodowej dotknęły wnuków kobiet, które były w ciąży podczas głodu. Podobnie, w badaniu XIX-wiecznej ludności północnej Szwecji, która przechodziła cykle głodu i obfitości, ilość dostępnej żywności wydaje się mieć wpływ na zdrowie i długowieczność następnego pokolenia.
kolor włosów u myszy może być określony przez efekt epigenetyczny
prawdopodobnie najbardziej znanym przykładem transgeneracyjnych efektów epigenetycznych jest gen agouti myszy. Gen ten kontroluje kolor włosów i jest włączany we właściwym czasie w komórkach mieszków włosowych, aby wytworzyć żółty pasek w ciemnych włosach, co powoduje tzw. płaszcz agouti. Ale myszy ze szczególnym wariantem genu Agouti zwanym Avy mają płaszcze, które są pomiędzy żółtym a normalnym ciemnym (agouti) wzorem myszy typu dzikiego. Żółte myszy również stają się otyłe i cierpią na inne problemy zdrowotne. Tak więc Gen Avy wydaje się mieć zmienny efekt (w rzeczywistości Avy oznacza Avariable yellow). Sposób, w jaki to działa, zastanawiał genetyków od lat, ale teraz możemy uznać to za efekt epigenetyczny. Żółte futro występuje, ponieważ Avy wersja genu Agouti ma wadliwe sterowanie i jest włączony przez cały czas. Jednakże, methyl tags są często dodawane do wadliwej kontrolnej sekwencji DNA i to ma tendencję do wyłączania genu, co powoduje cętkowane lub ciemne futro aguti u poszczególnych myszy. Szczenięta urodzone przez matki o zakresie genów Avy w Kolorze od żółtego do ciemnego, ale proporcja zależy od koloru sierści matki; mioty ciemnych (agouti) samic częściej zawierają ciemne szczenięta. Ponadto większy odsetek ciemnego potomstwa obserwuje się, gdy zarówno matka, jak i babcia mają ciemną barwę. Tak więc zabarwienie agouti, które jest określane epigenetycznie (przez liczbę znaczników metylowych w genie Avy), może do pewnego stopnia przenosić się z jednego pokolenia na drugie.
jaja i plemniki zwykle nie przenoszą efektów epigenetycznych
chociaż możemy znaleźć przypadki, w których efekty epigenetyczne najwyraźniej trwają od rodziców do potomstwa, zwykle tak nie jest i prawie wszystkie przełączniki lub znaki epigenetyczne są resetowane w komórkach zarodkowych (jajach i plemnikach) iw najwcześniejszych stadiach rozwoju zarodka. W rzeczywistości, gdyby tak nie było, niesamowity rozwój zapłodnionego jaja w w pełni uformowane stworzenie byłby niemożliwy.
przechodząc z zapłodnionego jaja do w pełni uformowanego człowieka, wszystko to znajduje się w genomie (epi)
do tej pory opisywaliśmy pewne szczególne przypadki regulacji epigenetycznej, ale teraz wiemy, że epigenetyka w szerokim tego słowa znaczeniu (sposób ekspresji i wykorzystania genów, a nie sekwencja DNA samych genów) ma kluczowe znaczenie dla tego, w jaki sposób zapłodnione jajo może ostatecznie spowodować powstanie całego organizmu i jak komórki, powiedzmy skóry, pozostają komórkami skóry i różnią się od komórek mózgu, mimo że zawierają dokładnie to samo, co komórki mózgu.te same geny. Wkrótce po zapłodnieniu rozwijający się embrion ludzki składa się z kuli komórek zwanych embrionalnymi komórkami macierzystymi. Każda z tych komórek ma zdolność do powstawania dowolnego rodzaju komórek w organizmie, gdy zarodek rośnie (na przykład komórki mózgu, komórki skóry lub komórki krwi). Natomiast 9 miesięcy później, gdy dziecko się rodzi, większość komórek tworzących jego ciało jest zobowiązana do bycia określonym rodzajem komórki o określonych funkcjach. Tak więc, gdy komórki dzielą się, kula embrionalnych komórek macierzystych stopniowo rozwija się we wszystkie typy komórek i struktury dziecka w czasie. Aby tak się stało, tysiące genów musi być włączane lub wyłączane we właściwym czasie i we właściwych komórkach, gdy zarodek rośnie. Na przykład geny, które wytwarzają włókniste białko keratyny, które daje naszej skórze siłę, są włączane tylko w komórkach skóry, a nie w rozwijającym się mózgu, a geny wymagane do rozwoju komórek mózgowych i ich wzajemnych połączeń są włączone w mózgu, ale nie w skórze.
podczas rozwoju geny muszą być włączone i wyłączone. Znaczniki epigenetyczne pomagają w tym
bardzo duży obszar badań dotyczy dzisiaj tego, jak działa całe to przełączanie genów na wyłączanie, a duża część tego procesu wykorzystuje epigenetyczne znaczniki chemiczne, zwłaszcza znaczniki acetylowe i metylowe histonów. Aby te embrionalne komórki macierzyste mogły dać początek wszystkim innym rodzajom komórek, ich przełączniki epigenetyczne są (prawie) całkowicie resetowane w porównaniu z komórkami dorosłymi. Umieściłem „prawie” w nawiasie, ponieważ wiemy z odciśniętych genów i transgeneracyjnego dziedziczenia epigenetycznego, że istnieją wyjątki.
epigenetyka, owca Dolly i przyjaciele
w lutym 1997 roku owca o imieniu Dolly stała się najbardziej znanym przykładem jej gatunku, na krótko stając się nawet gwiazdą telewizyjną. Powodem jej sławy jest to, że była pierwszym ssakiem, który został „stworzony” w procesie zwanym transferem jądrowym komórek somatycznych, lub innymi słowy pierwszym klonem stworzonym przez człowieka (stworzonym przez człowieka, aby odróżnić się od identycznych bliźniąt, które są naturalnymi klonami). Proces prowadzący do jej narodzin wymagał dojrzałego oocytu (niezaprzeczalnego jaja) od jednej samicy owcy i zwykłej komórki z wymion drugiej owcy. Najpierw jądro (część zawierająca DNA) zostało usunięte z oocytu. Zrobiono to za pomocą specjalnego mikroskopu, ponieważ chociaż oocyty są dość duże w porównaniu do innych komórek, nadal są zbyt małe, aby zobaczyć je gołym okiem. Następnie jądro z komórki wymienia wstawiono do enukleowanego oocytu. Tak więc Dolly miała trzy „matki”: dawcę oocytów, dawcę komórek wymion i owce, które przenosiły rozwijający się zarodek do terminu. Żaden ojciec nie był w to zamieszany. Chociaż proces ten był i pozostaje bardzo nieefektywny, był to pierwszy dowód na to, że geny z dorosłej komórki ssaka można „epigenetycznie przeprogramować” z powrotem do stanu embrionalnych komórek macierzystych, które mogą rozwinąć się w dowolny inny typ komórki. Następnie ten sam proces został zastosowany do innych gatunków i może mieć zastosowanie medyczne w wytwarzaniu komórek, które mogłyby naprawiać tkanki uszkodzone przez uraz lub chorobę.
podsumowanie: epigenom i projekt ENCODE – ” duży Zderzacz Hadronów „w biologii
podczas gdy termin” Genom ” odnosi się do całej sekwencji DNA organizmu (trzy miliardy liter dla ludzi), epigenom odnosi się do całego wzorca modyfikacji epigenetycznych we wszystkich genach, w tym methyl DNA tags, methyl histone tags, acetyl histone tags i inne chemiczne tagi, o których nie wspomnieliśmy, w każdym typie komórkowym organizmu. Stanowi to niemal niewyobrażalną ilość informacji, przyćmiewającą nawet projekt ludzkiego genomu. Niemniej jednak znajomość epigenomu jest niezbędna, aby w pełni odpowiedzieć na niektóre z największych pytań w biologii, takich jak: Jak rozwinąć się z kuli identycznych komórek w cały organizm? dlaczego się starzejemy? jak lepiej zrozumieć choroby takie jak rak? Nic więc dziwnego, że epigenetyka i epigenom to duży obszar badań. Niektóre z badań w tej dziedzinie są objęte projektem ENCODE (Encyclopedia of DNA Elements), trwającym przedsięwzięciem mającym na celu identyfikację wzorców znaczników epigenetycznych w wielu różnych typach komórek dla całego ludzkiego genomu (http://genome.ucsc.edu/ENCODE/). Projekt ENCODE jest czasami porównywany do Wielkiego Zderzacza Hadronów lub LHC w Szwajcarii. LHC jest największym sprzętem naukowym, jaki kiedykolwiek zbudowano, a eksperymenty prowadzone z nim przez fizyków mają na celu zbadanie podstawowych szczegółów materii składającej się na nasz Wszechświat. Chociaż biolodzy nie mają (lub nie potrzebują) tak spektakularnego zestawu do swoich badań, wysiłek zbadania zawiłości ludzkiego epigenomu został porównany do projektu LHC ze względu na jego skalę, złożoność i ilość wytwarzanych informacji.
błędy epigenetyczne
epigenetyka to dziedzina, w której nasza wiedza naukowa szybko rośnie. Naukowcy odkryli, że błędy epigenetyczne są powszechne w chorobach takich jak rak i w starzejących się komórkach. W rezultacie naukowcy opracowują leki ukierunkowane na wadliwe epigenomy, a jednym z pierwszych przykładów jest zastosowanie inhibitorów HDAC, podobnych do Związku znajdującego się w mleczku pszczelym. Z badań nad dziwnymi wzorcami dziedziczenia, takimi jak imprinting genetyczny, żółta/agouti Avy mysz, żeńska populacja kotów szylkretowych i inne pokrewne zjawiska biolodzy odkryli zupełnie nową warstwę informacji, która leży „na górze” sekwencji DNA naszych genów. Te nowe odkrycia wyjaśniają te poprzednie zagadkowe obserwacje, ale także mają ogromny potencjał do nowego zrozumienia i leczenia chorób ludzkich.
Czytaj dalej:
- Bird, Adrian. „Epigenetyka. Natychmiastowy ekspert nr 29”, New Scientist, 5 stycznia 2013, nr 2898.
- Carey, Nessa. „The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance”. Wydawca: Icon Books. Oprawa Miękka 1 marca 2012 r. ISBN-10: 1848313470. Cena RRP 9-99 zł.
wpływy epigenetyczne i choroby na stronie:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply