CIMAvax-EGF: A novel therapeutic vaccine for advanced lung cancer
REPORT
CIMAvax-EGF: A novel therapeutic vaccine for advanced lung cancer
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatrice García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Eliya Neninger2
1Center of Molecular Immunology, CIMAve. 216 corner 15, Atabey, Plaża, POBox 16 040, Hawana ,Kuba
2hermanos Ameijeiras HospitalSan Lazarus # 701 e/ Belascoín i markiz Gonzalez, biznes Hawana, miasto Hawana, Kuba.
streszczenie
przedstawiono wyniki umożliwiające kubańskiej agencji regulacyjnej (Cecmed) przyznanie rejestracji sanitarnej szczepionki przeciw rakowi CIMAvax-EGF przeciwko zaawansowanemu niedrobnokomórkowemu rakowi płuc (NSCLC). Była to pierwsza rejestracja szczepionki terapeutycznej na Kubie, a także pierwsza rejestracja szczepionki przeciwko rakowi płuc na świecie. W związku z tym pacjentom z rakiem płuc oferuje się unikalną szczepionkę terapeutyczną, która zwiększy przeżywalność i jakość ich życia. W tym celu należało zmierzyć się ze znaczącymi wyzwaniami przedklinicznymi, klinicznymi, regulacyjnymi, produkcyjnymi i negocjacyjnymi. Wyniki uzyskane w tych dziedzinach doprowadziły do 18 prac naukowych opublikowanych w czasopismach o dużym wpływie i 4 obiektów wynalazczych, generując kilka patentów na Kubie i innych krajach. W Warunkach przedklinicznych wykazano immunogenność, Bezpieczeństwo i działanie przeciwnowotworowe u różnych gatunków zwierząt. Doświadczenie kliniczne rozpoczęło się w 1995 roku. Do tej pory zakończono pięć badań klinicznych fazy I-II na Kubie, zakończono również dwa badania II Fazy, jedno na Kubie, a drugie w Kanadzie i Wielkiej Brytanii, a na Kubie trwa obecnie badanie II-III fazy ze zoptymalizowanym harmonogramem, a także badanie III fazy. W dziedzinie regulacji opracowano i wdrożono strategię szybkiej rejestracji. Opracowanie tego unikalnego produktu wymagało nowych koncepcji regulacyjnych. Przeprowadzono skalowalny, powtarzalny i kontrolowany proces produkcyjny wraz z systemem jakości zapewniającym pełną zgodność z GMP. Środki na rozwój produktu pochodziły z wdrożenia nowatorskiej strategii negocjacyjnej: negocjacji wartości niematerialnych i prawnych.
słowa kluczowe: szczepionka przeciw rakowi, NSCLC, Szybka rejestracja, CIMAvax-EGF, badanie kliniczne fazy II-III
wprowadzenie
związek między układem utworzonym przez receptor naskórkowego czynnika wzrostu (EGFR) a jego ligandami z rozwojem raka jest dobrze znany. W guzach pochodzenia naskórkowego występuje nadmierna ekspresja EGFR, która odnosi się do złych rokowań i wczesnych nawrotów po operacji. Dlatego ten system stał się ważnym celem terapii przeciwnowotworowych.
mechanizmy proliferacji komórek inicjowane są poprzez wiązanie EGF z EGFR. Nasze podejście terapeutyczne składa się ze szczepionki z formułą EGF, co czyni ją immunogenną i indukuje humoralną odpowiedź immunologiczną. Wytwarzanie specyficznych przeciwciał anty-EGF, które wiążą się z autologicznym EGF, zapobiega wiązaniu się go z EGFR, uruchamiając w ten sposób mechanizmy proliferacji komórek pochodzące z tej interakcji (1-4).
tutaj przedstawiamy wyniki rejestracji na Kubie tej szczepionki (CIMAvax-EGF). Było to częścią globalnej strategii obejmującej nowatorski wkład kliniczny, regulacyjny oraz technologiczny i biznesowy i jest wspierane przez 18 międzynarodowych prac naukowych i własność intelektualną na całym świecie. Opisujemy również innowacje w różnych dziedzinach, które umożliwiły rejestrację CIMAVAX-EGF na Kubie i w Peru.
wyniki i dyskusja
szczepienie EFG jest bezpieczne, immunogenne i zwiększa przeżywalność przy dobrej jakości życia u pacjentów w zaawansowanym stadium raka płuc
doświadczenie kliniczne z CIMAvax-EGF w leczeniu niedrobnokomórkowego raka płuc (NSCLC) w zaawansowanym stadium rozpoczęto w 1995 r. Do tej pory zakończono pięć badań klinicznych fazy I-II na Kubie; zakończono 2 randomizowane badania kliniczne fazy II, jedno na Kubie, a drugie w Kanadzie i Wielkiej Brytanii, a na Kubie trwa badanie fazy III. Ponad 800 pacjentów z zaawansowanym rakiem było leczonych produktem CIMAvax–EGF, co dowodzi, że jest on bezpieczny, immunogenny i zdolny do zwiększenia przeżycia przy dobrej jakości życia.
głównym celem badań fazy I-II było określenie najlepszej postaci szczepionki (białka nośnika i adiuwanta), dawki i schematu leczenia. Wyniki te wykazały zalety białka P64k jako białka nośnikowego i Montanidu ISA51 jako adiuwanta. Wykazano również zwiększoną immunogenność zwiększenia dawki (5-7).
analiza zbiorczych danych ze wszystkich badań fazy I-II wykazała znaczące zwiększenie przeżycia u pacjentów z lepszą odpowiedzią na przeciwciała lub dobrą odpowiedzią na przeciwciała (GAR) oraz u pacjentów z wyraźniejszym zmniejszeniem stężenia sera EGF () wynikającym ze szczepienia. Wykazano również znaczne zwiększenie przeżycia wszystkich zaszczepionych pacjentów w porównaniu z równoczesną kontrolą historyczną (7).
przeprowadzono badanie kliniczne II fazy z udziałem 80 pacjentów, którzy zostali losowo przydzieleni do grupy otrzymującej CIMAvax-EGF i najlepsze leczenie wspomagające (BSC) (40 pacjentów) lub BSC w monoterapii (40 pacjentów), po zakończeniu chemioterapii pierwszego rzutu. Poprzednie ustalenia zostały potwierdzone w tym badaniu. Około 50% zaszczepionych pacjentów miało GAR i przeżyło znacznie więcej niż pacjenci, którzy nie osiągnęli klasyfikacji gar (którzy zostali sklasyfikowani jako osoby słabo reagujące na przeciwciała, PAR). Podobnie, pacjenci z największym zmniejszeniem przeżyli znacznie więcej niż pacjenci, którzy nie wykazali tego zmniejszenia(Tabela 1). Zaobserwowano istotną odwrotną korelację między mianami przeciwciał anty-EGF a, która wystąpiła u zaszczepionych pacjentów, ale nie w grupach kontrolnych, co dowodzi, że była ona spowodowana szczepieniem (ryc. 1).
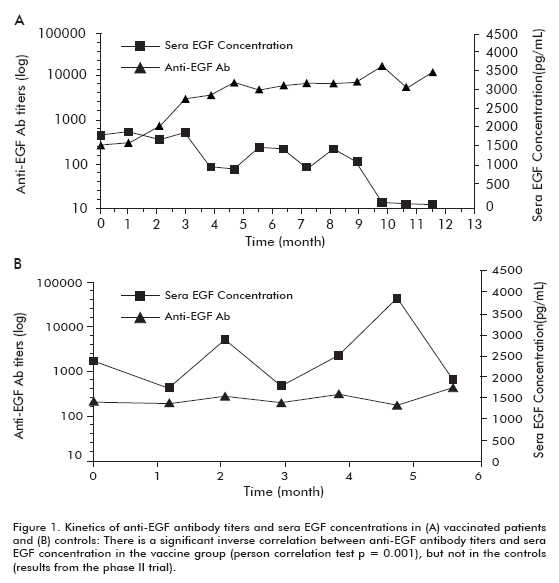
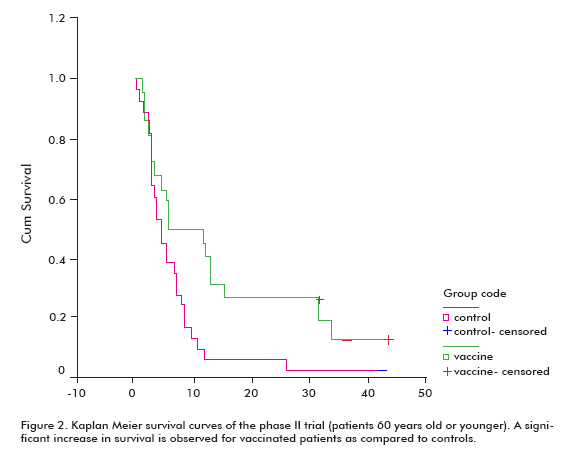
zaobserwowano zwiększoną tendencję przeżycia u wszystkich zaszczepionych pacjentów (18, 53 ± 11, 47; średnia ± mediana) w porównaniu z nieszczepionymi grupami kontrolnymi (7, 55 ± 5.33), co było istotne w grupie pacjentów w wieku 60 lat lub młodszych (test log rank; p < 0,05) (rycina 2) (8).
jak wykazano w teście konkurencji in vitro, surowice od zaszczepionych pacjentów hamowały Wiązanie EGF z EGFR. To hamowanie wiązania było proporcjonalne do miana przeciwciał i czasu przeżycia. Ponadto surowice od zaszczepionych pacjentów hamowały fosforylację EGFR proporcjonalnie do miana przeciwciał anty-EGF.
badano preferencyjne uznanie miejsca wiązania EGF/EGFR (pętla B cząsteczki EGF). Pacjenci, u których surowice preferencyjnie rozpoznają pętlę B, przeżyli znacznie więcej niż pacjenci, którzy nie rozpoznali tego epitopu (9).
na Kubie niedawno zakończono badanie optymalizacji dawki/schematu leczenia (faza I-II). W jego konstrukcji uwzględniono wszystkie elementy zwiększające immunogenność w poprzednich badaniach, w tym: Montanid ISA51 jako adiuwant, zwiększone dawki, cztery miejsca wstrzyknięć i podanie dwóch dawek szczepionki przed chemioterapią pierwszego rzutu, a następnie szczepienie. Wyniki tego badania wykazały znaczny wzrost immunogenności, przy czym 95% GAR osiągnęło dziesięciokrotnie wyższe niż poprzednie maksymalne miana przeciwciał. Wszystkie szczepione pa-tienty przeżyły znacznie więcej niż grupy kontrolne z badania II fazy (10).
stwierdzono również zwiększoną zdolność surowic pacjentów do hamowania wiązania EGF/EGFR i fosforylacji EGFR. W siódmym miesiącu, po zakończeniu chemioterapii, odpowiedź przeciwciała przesunęła się w kierunku pętli B cząsteczki EGF, co może wskazywać na poprawę jakości odpowiedzi immunologicznej. Wyniki tego badania wykazały, że istnieje margines poprawy w odpowiedzi na leczenie produktem CIMAvax-EGF, który można osiągnąć poprzez manipulowanie dawką i schematem leczenia (10).
wyniki tych badań są zatwierdzane w trwającym obecnie badaniu III fazy na Kubie.
zaprojektowanie i wdrożenie strategii regulacyjnej w zakresie rejestracji szczepionek w celu udostępnienia jej wszystkim pacjentom z zaawansowanym niedrobnokomórkowym rakiem płuc
CIMAvax-EGF jest unikalną na świecie szczepionką terapeutyczną przeciwko rakowi płuc. Zaprojektowano i wdrożono globalną strategię; kierowano się wymogami regulacyjnymi, dotyczącymi szybkiej rejestracji na Kubie. Bliskie relacje między sponsorem (CIM) a kubańską agencją regulacyjną (CECMED) miały na celu ustalenie wymagań dotyczących uzyskania produktu i jego szybkiego zastosowania z korzyścią dla pacjentów z zaawansowanym rakiem, bez żadnej innej alternatywy terapeutycznej. Strategia ta obejmowała zaprojektowanie systemu jakości, kontroli jakości i specyfikacji, a także wymagania GMP obejmujące różne etapy rozwoju produktu. Ta globalna strategia może być wykorzystana w rozwoju innych podobnych produktów.
zgromadzone doświadczenie regulacyjne i dokumentacja doprowadziły do zatwierdzenia badań klinicznych w różnych krajach. Dokumentacja zawierająca wszystkie informacje umożliwiła rejestrację produktu CIMAvax-EGF na Kubie i w Peru. Możemy zatem stwierdzić, że mamy zdefiniowaną strategię rejestracji leków w różnych krajach.
proces produkcji GMP, który wytwarza produkt, który jest skalowalny, spójny i Zgodny ze specyfikacjami
pierwszym wyzwaniem związanym z zaprojektowaniem procesu produkcji produktu CIMAvax-EGF było posiadanie immunogennego preparatu EGF. Otrzymano go przez chemiczną koniugację ludzkiego rekombinowanego EGF z rekombinowanym białkiem błonowym, P64k (z Neisseria meningitidis). Koniugat wstrzykuje się razem z odpowiednim adiuwantem (obecnie Montanid Isa 51 Z Seppic, Francja).
początkowo zaprojektowano proces w skali laboratoryjnej. Skalowalny (i skalowalny) sanitarny i powtarzalny proces został później zaprojektowany i wdrożony, zgodnie z wytycznymi GMP. Zaprojektowano i wdrożono również testy analityczne in vitro i in vivo w celu oceny jakości surowców oraz produktów pośrednich i końcowych.
wszystkie zmiany zostały ocenione i poparte obecną strategią regulacyjną. Wyniki badania równoważności, w celu porównania obu produktów, otrzymały zatwierdzenie przez CECMED aplikacji procesu skalowanego i zatwierdzenie produktu uzyskanego w tym procesie do jego zastosowania klinicznego. Skalowanie i optymalizacja procesu produkcyjnego ustąpiły miejsca publikacji (11) i nowemu obiektowi wynalazczemu, którego patenty zostały następnie zaprezentowane w różnych krajach.
negocjowanie wartości niematerialnych i prawnych dało nam środki na rozwój projektu, a także zdobycie doświadczenia we wspólnej pracy z organami regulacyjnymi z różnych krajów
projekt ten był negocjowany z zagranicznymi odpowiednikami w oparciu o nowatorską koncepcję „negocjowania wartości niematerialnych i prawnych”, wspieraną głównie poprzez własność intelektualną naszego produktu, który był w trakcie opracowywania. Ta strategia negocjacyjna polegała na licencjonowaniu projektu na jego wspólny rozwój z innymi krajami, co oznacza, że zagraniczne odpowiedniki pokryły koszty działań regulacyjnych i badań klinicznych na ich terytoriach. W wyniku tych negocjacji Kuba otrzymała płatności za kamienie milowe. Ten sposób negocjacji pozwolił nam również na stałą wymianę ze specjalistami w kraju i za granicą, zwiększając tym samym nasze doświadczenie. Nasze pozytywne wyniki dzięki tej modalności negocjacji można by zastosować do innych produktów w toku w naszym kraju.
Znaczenie badania
CIMAvax-EGF jest pierwszą szczepionką terapeutyczną do leczenia raka zarejestrowaną na Kubie i pierwszą zarejestrowaną na świecie do leczenia raka płuc. Rak płuc jest nierozwiązanym problemem zdrowotnym z ponad 1,3 miliona przypadków diagnozowanych każdego roku i taką samą liczbą zgonów na całym świecie. Na Kubie jest główną przyczyną zgonów z powodu raka u obu płci z częstością ponad 4000 zmarłych rocznie. Preferowaną terapią dla pacjentów rozpoznanych w zaawansowanym stadium jest chemioterapia pierwszego rzutu, która może być podawana jednocześnie z radioterapią. Jest to leczenie paliatywne, nieleczące, przy czym całkowita odpowiedź na chemioterapię jest bardzo rzadka, a obiektywna odpowiedź (całkowita lub częściowa) występuje tylko u 25% pacjentów.
CIMAvax-EGF oferuje alternatywne leczenie dla tych pacjentów, którzy otrzymali już chemioterapię pierwszego rzutu. Ciężkie działania niepożądane związane z chemioterapią i/lub radioterapią są dobrze znane i poważnie pogarszają jakość życia. Zamiast tego, szczepienie produktem CIMAvax-EGF wywołuje jedynie łagodne lub umiarkowane, a nie ciężkie działania niepożądane, które można rozwiązać za pomocą konwencjonalnego leczenia wspomagającego, poprawiając jednocześnie przeżywalność pacjentów z zaawansowanym rakiem płuc i oferując dobrą jakość życia.
do tej pory ponad 800 Kubańczyków było leczonych lekiem CIMAvax-EGF w ponad 20 szpitalach w całym kraju. Rejestracja produktu CIMAvax-EGF pozwala na rozszerzenie go na wszystkich pacjentów w kraju, u których zdiagnozowano zaawansowanego raka płuc; czyniąc Kubę pierwszym krajem na świecie z Narodowym Programem wykorzystującym tę alternatywę terapeutyczną.
Jeśli chodzi o korzyści ekonomiczne, dzięki negocjacjom tego projektu uzyskaliśmy 6,346 mln USD. Strategia negocjacyjna projektu polega na jego wspólnym rozwoju z innymi krajami, co oznacza, że zagraniczny odpowiednik pokrywa koszty badań klinicznych w ich własnym kraju, dzięki czemu jest przystępny cenowo. Próby te wymagają inwestycji w wysokości milionów USD, a jest to możliwe tylko wtedy, gdy są wspierane przez zagranicznych kontrahentów. Jednocześnie strategia ta oferuje Kubie więcej danych klinicznych, bez kosztów przeprowadzania badań tutaj. Do tej pory badania kliniczne przeprowadzono w Kanadzie, Wielkiej Brytanii i Malezji. W niedalekiej przyszłości rozpoczną się badania kliniczne w Chinach i Europie.
ponadto, w ramach tej strategii licencjonowania, zagraniczni kontrahenci są odpowiedzialni za rejestrację produktów w regionach, w których mają prawa handlowe. Podczas procesów rejestracji i marketingu Kuba otrzyma płatności za kamienie milowe, a później jako tantiemy sprzedażowe.
światowy rynek szczepionek przeciwnowotworowych jest uważany za rzędu miliardów USD. Fakt, że Kuba ma unikalny produkt do zaawansowanego leczenia raka płuc, może zapewnić nam potencjał eksportowy, który może finansować stosowanie tego produktu w naszym krajowym systemie opieki zdrowotnej.
wnioski
szczepienie produktem CIMAvax-EGF jest bezpieczne, immunogenne i prowadzi do zwiększenia przeżycia i dobrej jakości życia u pacjentów z guzami płuc w zaawansowanym stadium. Projekt i wdrożenie strategii regulacyjnej w zakresie rejestracji tej szczepionki udostępniło ją
we wszystkich przypadkach pacjentów z zaawansowanym niedrobnokomórkowym rakiem płuc na Kubie. To pozytywne doświadczenie może mieć zastosowanie do innych podobnych produktów w toku. Opracowano proces produkcyjny, który był skalowalny, spójny i powtarzalny oraz zgodny z wytycznymi GMP, aby wygenerować produkt zgodny ze specyfikacjami. Doświadczenie w negocjowaniu wartości niematerialnych i prawnych było bardzo pozytywne i dało nam fundusze na rozwój projektów, wspierając jednocześnie doświadczenie zdobyte we wspólnej pracy z organami regulacyjnymi różnych krajów.
podziękowania
autorzy chcą podziękować następującym specjalistom z Centrum Immunologii molekularnej za ich uznanie dla tej pracy: Rolando Perez, Лоани Calvo, Сухами Atencio, Belinda Sanchez, Irene Beausoleil, Ernesto Chico, Айрама Альвиса, Ileana Картроман, Sergio Kata, Ana Велозо, Reinaldo Cuervo, Янельда Lopez, Йосниэль Hernandez, Antonio Валлин, Alejandro Portillo, Люва Madera, Guido Ferrer, Diana Borges, Ниувис Perez, Robert Garcia, Идейн Cuenca, Myra Сантаелена, Joaquin Солозабаль, Aida Rodriguez, Maria Elena Garcia, Afis Torres, Eric Chong, Carmen Виада, Mauricio Cathala, Сорайда Acosta, Barbara Wilkinson, Olga Torres, Jaguar Iznaga all of them from the center of molecular Immunology, and also to Daniel González, Lourdes B Costa, Galina m Moya, Rolando Páez, Gerardo Guillén , Vivian Pujol, Dinorah Torres z Centrum inżynierii genetycznej i Biotechnologii.
1. González G, Montero E, León K, Cohen IR, Lage A. autoimmunizacja do naskórkowego czynnika wzrostu, składnika homunkulusa im-munologicznego. Autoimmun Rev 2002;1: 89-95.
2. Lage a, Crombet T, González G. Targeting epidermal growth factor receptor signalling: early results and future trends in oncology. Ann Med 2003;5(35):327-36.
3. González G i Lage A. szczepionki przeciw rakowi przeciwko deprywacji immunologicznej hormonów: The EGF Vaccine Approach: Leading Topics in Cancer Research, Chapter 11, Ed Nova Publishers, 2007.
4. González G i Lage A. Cancer vaccines for hormone/growth factor Immune deprivation: a really approach for cancer treatment. Curr Cancer Drug Targets 2007; 7: 229-41.
5. González G, Crombet T, Torres F,Catala m, Alfonso L, Osorio m, et al. Szczepionka przeciwnowotworowa oparta na naskórkowym czynniku wzrostu do niedrobnokomórkowego leczenia raka płuc. Ann Oncol 2003;14: 461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Leczenie pacjentów z NSCLC szczepionką przeciwnowotworową opartą na EGF. Raport z badania fazy I. Cancer Biol Ther 2006;5(2):136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. szczepienia terapeutyczne naskórkowym czynnikiem wzrostu (EGF) w zaawansowanym raku płuc: analiza zbiorczych danych z trzech badań klinicznych. Humor 2007;3 (1): 8-13.
8. Neninger E, De la Torre A, Osorio M, Catald m, Bravo I, Mendoza m, et al. Randomizowane, kontrolowane badanie II Fazy szczepionki przeciw naskórkowemu czynnikowi wzrostu w zaawansowanym niedrobnokomórkowym raku płuca. J Clin Oncol 2008;26: 1452-8.
9. García B, Neninger E, De la Torre A, Leonard I, Martínez R, Viada C, et al. Skuteczne hamowanie wiązania receptora naskórkowego czynnika wzrostu/naskórkowego czynnika wzrostu przez przeciwciała przeciwko Naskórkowemu czynnikowi wzrostu jest związane z lepszym przeżyciem u pacjentów z zaawansowanym niedrobnokomórkowym rakiem płuc leczonych szczepionką przeciw Naskórkowemu czynnikowi wzrostu. Clin Cancer Res 2008; 14 (3): 840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda s, Leonard I, et al. Połączenie szczepionki przeciwnowotworowej opartej na EGF z chemioterapią w zaawansowanym niedrobnokomórkowym raku płuc. J Immunother 2009; 32: 92-9.
11. Rodriguez g, Albisa a, Vina l, Cuevas A, Garcia B, Garcia At i in. Manufacturing process development for an epidermal growth Factor based Cancer vaccine. Bio-pharm Int, Vaccines Suppl, Oct 2008.
Leave a Reply