Chemia: czym są kwasy i zasady?
czym są kwasy i zasady?
chociaż powiedziałem wam, że kwasy i zasady nie są trudne do zrozumienia, mam złą wiadomość: istnieje nie jedna, ale trzy wspólne definicje używane do opisu kwasów i zasad: kwasy i zasady Arrheniusa, kwasy i zasady Brnsted-Lowry ’ ego oraz kwasy i zasady Lewisa. Chociaż brzmi to tak, jakbyś musiał nauczyć się o kwasach i Zasadach trzy razy, dobrą wiadomością jest to, że dla wielu praktycznych celów, te trzy definicje są mniej więcej równoważne.
kwasy i zasady Arrheniusa
pod koniec XIX wieku nasz stary przyjaciel Svante Arrhenius wymyślił definicje kwasów i zasad podczas pracy nad problemami kinetycznymi.
według Arrheniusa kwasy są związkami, które rozpadają się w wodzie, wydzielając jony hydroniowe (H+). Częstym przykładem kwasu Arrheniusa jest kwas solny (HCl):
- HCl ? H + + Cl –
wzory kwasów zwykle zaczynają się od wodoru, chociaż kwasy organiczne są godnym uwagi wyjątkiem. Nazwy i wzory niektórych popularnych kwasów podano w poniższej tabeli:
| Nazwa kwasu | wzór |
|---|---|
| kwas chlorowodorowy | HCl |
| kwas azotowy | HNO3 |
| kwas fosforowy | H3PO4 |
| kwas siarkowy | H2SO4 |
| kwas octowy | C2H4O2 |
Zasady Arrheniusa są zdefiniowane jako związki, które powodują powstawanie jonu wodorotlenkowego po umieszczeniu w wodzie. Przykładem Zasady Arrheniusa jest wodorotlenek sodu (NaOH):
- NaOH ? Na+ + OH-
bazy zazwyczaj mają „OH” w swoich formułach, choć istnieją wyjątki. Na przykład amoniak (NH3) nie zawiera jonów wodorotlenowych, ale tworzy je, gdy reaguje z wodą:
- NH3 + H2O ? NH4 + + OH –
nazwy i formuły niektórych wspólnych baz znajdują się w poniższej tabeli:
| Nazwa bazy | wzór |
|---|---|
| amoniak | NH3 |
| wodorotlenek potasu | KOH |
| wodorowęglan sodu | NaHCO3 |
| węglan sodu | Na2CO3 |
| wodorotlenek sodu | NaOH |
niektóre tlenki tworzą kwasy lub zasady po dodaniu wody. Ponieważ związki te nie zawierają żadnych jonów H+ lub OH -, chyba że reagują z wodą, nazywane są ” bezwodnikami.”Zazwyczaj tlenki niemetali są bezwodnikami kwasowymi (tworzą kwas po umieszczeniu w wodzie), a tlenki metali są bezwodnikami zasadowymi (tworząc zasadę po umieszczeniu w wodzie).
Brnsted-Lowry kwasy i zasady
na początku 1900 roku, alternatywna definicja kwasów i zasad została zaproponowana przez Johannesa Brnsteda i Thomasa Lowry ’ ego, aby wyjaśnić fakt, że amoniak może zneutralizować kwasowość HCl, nawet jeśli woda nie jest obecna. Zjawisko to pokazało im, że amoniak jest zasadą, nawet jeśli nie ma wody wokół, aby utworzyć jony wodorotlenkowe.
istnieje wiele różnych nazw i wzorów używanych do opisu jonu hydroniowego. Chociaż wzór był wcześniej pokazywany jako ” H+”, czasami jest zapisywany jako „H3O”, ponieważ jest to jon utworzony, gdy H+ łączy się z wodą. Innym powszechnym sposobem odniesienia się do jonów hydroniowych jest po prostu nazywanie ich „protonami.”Nazwa ta pochodzi od faktu, że H+ reprezentuje atom wodoru (jeden proton i jeden elektron), który stracił swój elektron, pozostawiając tylko nagi proton.
kwas Brnsted-Lowry jest zdefiniowany jako związek, który daje jony hydroniowe innemu Związkowi?na przykład kwas solny daje jony H+ związkom, z którymi reaguje. Zasady Brnsted-Lowry są związkami, które mogą przyjmować jony hydroniowe?gdy amoniak otrzymuje jon hydroniowy z HCl, tworzy jon amonowy.
poniższe równanie przedstawia reakcję kwasu Brnsted-Lowry z zasadą Brnsted-Lowry:
- HNO3 + NH3 ? NO3 – + NH4 +
w tej reakcji kwas azotowy zachowuje się jak kwas, ponieważ daje proton do amoniaku. Amoniak zachowuje się jak zasada, ponieważ przyjmuje proton z kwasu azotowego.
jednak, jeśli spojrzeć na drugą stronę równania, znajdziemy jony azotanu i amonu. Ponieważ jon azotanowy może przyjmować protony z jonu amonowego (tworząc HNO3), jon azotanowy jest bardzo słabą zasadą Brnsted-Lowry. Ponieważ jon amonowy ma dodatkowy proton do oddania (w tym przypadku jon azotanowy), jest to kwas Brnsted-Lowry.
jon azotanowy opiera się na cząsteczce kwasu azotowego, więc mówimy, że jest to sprzężona zasada kwasu azotowego. Podobnie jon amonowy jest sprzężonym kwasem amoniaku. Razem kwas z jego sprzężoną zasadą (taką jak HNO3 i NO3-) lub zasadą z jego sprzężonym kwasem (taką jak NH3 i NH4+) określa się jako sprzężoną parę kwas-zasada.
kwasy i zasady Lewisa
w Brnsted-Lowry definicja kwasów i zasad, zasada jest zdefiniowana jako związek, który może przyjmować proton. Jak jednak przyjmuje proton?
jedną z cech, które Zasady Brnsted-Lowry mają ze sobą wspólną cechę, jest to, że mają nierozdzieloną parę elektronów. Kiedy Jon hydroniowy wędruje przez cząsteczkę, czasami samotne pary wyciągają się i chwytają ją. Przykładem tego jest, gdy amoniak przyjmuje proton w kwaśnym roztworze:
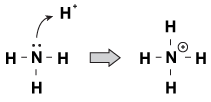
rysunek 23.1 amoniak może pobrać proton z kwasu azotowego z jego samotną parą elektronów.
jednym ze sposobów patrzenia na ten proces jest to, że atom amoniaku przekazuje swoją samotną parę protonowi. Ponieważ samotne pary napędzają tę reakcję chemiczną, mamy nową definicję kwasowości i zasadowości, zwaną „kwasowością/zasadowością Lewisa.”Zasada Lewisa jest związkiem, który przekazuje parę elektronową innemu Związkowi (amoniakowi w naszym przykładzie). Kwas Lewisa jest związkiem, który przyjmuje parę elektronową (jon H+ w naszym przykładzie).
Zasady Lewisa są związkami chemicznymi, które mogą przekazywać pary elektronów. Kwasy Lewisa są substancjami chemicznymi, które mogą je przyjmować.
chociaż w naszym przykładzie mieliśmy amoniak oddający samotną parę do protonu, samotna para w amoniaku może również reagować z wieloma innymi związkami. Na przykład amoniak może przekazać swoją samotną parę elektronów BH3 w następującym procesie:

rysunek 23.2 samotna para amoniaku przyłącza się do BH3.
w tym procesie amoniak jest zasadą Lewisa, a BH3 jest kwasem Lewisa.
Ogólnie Rzecz Biorąc, definicja Lewisa kwasów i zasad jest najbardziej użyteczna, ponieważ jest najbardziej obejmującą z trzech definicji. Na przykład definicja kwasu Brnsteda-Lowry ’ ego obejmuje HF, ale nie BH3, który nie traci protonu, gdy jest przyłączony przez samotne pary na bazie Lewisa.
fragment z kompletnego przewodnika po chemii 2003 autorstwa Iana Gucha. Wszelkie prawa zastrzeżone, w tym prawo do powielania w całości lub w części w dowolnej formie. Używany przez Alpha Books, członka Penguin Group (USA) Inc.
aby zamówić tę książkę bezpośrednio u wydawcy, odwiedź stronę internetową Penguin USA lub zadzwoń pod numer 1-800-253-6476. Możesz również kupić tę książkę w Amazon.com i Barnes & Noble.
Leave a Reply