Biologia dla kierunków i
efekty kształcenia
- Zidentyfikuj składniki prostych reakcji chemicznych
wszystkie elementy są najbardziej stabilne, gdy ich zewnętrzna powłoka jest wypełniona elektronami zgodnie z zasadą oktetu. To dlatego, że jest energetycznie korzystne dla atomów być w tej konfiguracji i sprawia, że są stabilne. Ponieważ jednak nie wszystkie pierwiastki mają wystarczająco dużo elektronów, aby wypełnić swoje zewnętrzne powłoki, Atomy tworzą wiązania chemiczne z innymi atomami, uzyskując w ten sposób elektrony, których potrzebują do osiągnięcia stabilnej konfiguracji elektronowej. Gdy dwa lub więcej atomów chemicznie wiążą się ze sobą, otrzymana struktura chemiczna jest cząsteczką. Znana cząsteczka wody, H2O, składa się z dwóch atomów wodoru i jednego atomu tlenu; łączą się one ze sobą, tworząc wodę, jak pokazano na rysunku 1. Atomy mogą tworzyć cząsteczki, oddając, akceptując lub dzieląc elektrony, aby wypełnić ich zewnętrzne powłoki.
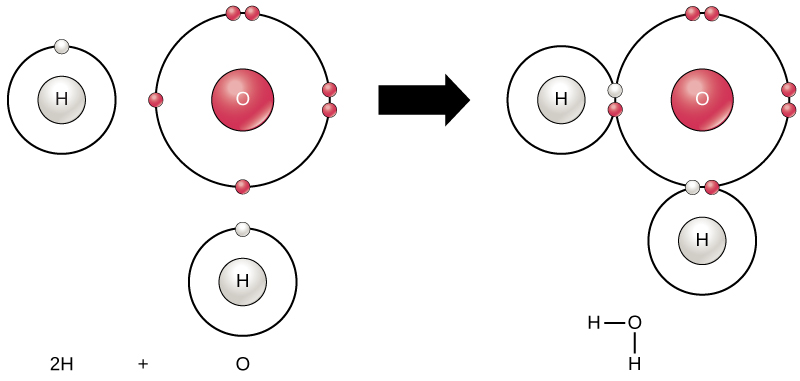
Rysunek 1. Dwa lub więcej atomów może wiązać się ze sobą tworząc cząsteczkę. Gdy dwa wodory i tlen dzielą elektrony poprzez wiązania kowalencyjne, powstaje cząsteczka wody.
reakcje chemiczne zachodzą, gdy dwa lub więcej atomów łączy się ze sobą tworząc cząsteczki lub gdy połączone atomy są rozdzielone. Substancje używane na początku reakcji chemicznej są nazywane reagentami (Zwykle znajdującymi się po lewej stronie równania chemicznego), a substancje znajdujące się na końcu reakcji są znane jako produkty (zwykle znajdowane po prawej stronie równania chemicznego). Strzałka jest zazwyczaj rysowane między reagentów i produktów, aby wskazać kierunek reakcji chemicznej; kierunek ten nie zawsze jest ” jednokierunkowa ulica.”Dla stworzenia cząsteczki wody pokazanej powyżej równanie chemiczne byłoby:
2H + o → H2O
przykładem prostej reakcji chemicznej jest rozpad cząsteczek nadtlenku wodoru, z których każda składa się z dwóch atomów wodoru połączonych z dwoma atomami tlenu (H2O2). Reagujący nadtlenek wodoru rozkłada się na wodę, zawierającą jeden atom tlenu związany z dwoma atomami wodoru (H2O) i tlen, który składa się z dwóch połączonych atomów tlenu (O2). W poniższym równaniu reakcja obejmuje dwie cząsteczki nadtlenku wodoru i dwie cząsteczki wody. Jest to przykład zrównoważonego równania chemicznego, w którym liczba atomów każdego pierwiastka jest taka sama po każdej stronie równania. Zgodnie z prawem zachowania materii liczba atomów przed i po reakcji chemicznej powinna być taka sama, aby w normalnych warunkach Atomy nie były tworzone ani niszczone.
2H2O2 (nadtlenek wodoru) → 2H2O(woda) + O2 (tlen)
mimo że wszystkie reagenty i produkty tej reakcji są cząsteczkami (każdy atom pozostaje związany z co najmniej jednym innym atomem), w tej reakcji tylko nadtlenek wodoru i woda są reprezentatywne dla podklasy cząsteczek znanych jako związki: zawierają Atomy więcej niż jednego rodzaju pierwiastka. Z drugiej strony, tlen cząsteczkowy, jak pokazano na fig. 2, składa się z dwóch podwójnie połączonych atomów tlenu i nie jest klasyfikowany jako związek, ale jako pierwiastek.
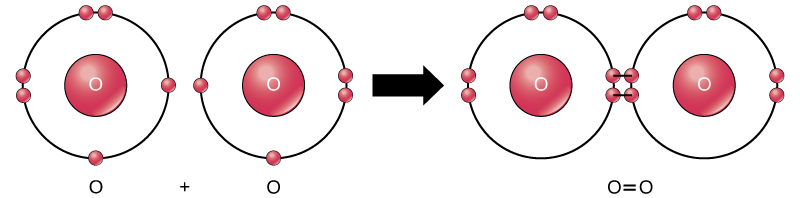
Rysunek 2. Atomy tlenu w cząsteczce O2 są połączone wiązaniem podwójnym.
niektóre reakcje chemiczne, takie jak pokazane powyżej, mogą przebiegać w jednym kierunku, dopóki reagenty nie zostaną zużyte. Równania opisujące te reakcje zawierają strzałkę jednokierunkową i są nieodwracalne. Reakcje odwracalne to te, które mogą przebiegać w dowolnym kierunku. W reakcjach odwracalnych reagenty są przekształcane w produkty, ale gdy stężenie produktu przekracza pewien próg (charakterystyczny dla danej reakcji), niektóre z tych produktów zostaną przekształcone z powrotem w reagenty; w tym momencie oznaczenia produktów i reagentów są odwrócone. To tam iz powrotem trwa aż do pewnej względnej równowagi między reagentów i produktów występuje-stan zwany równowagi. Takie sytuacje reakcji odwracalnych są często oznaczane przez równanie chemiczne z podwójną strzałką skierowaną zarówno w stronę reagentów, jak i produktów.
na przykład w ludzkiej krwi nadmiar jonów wodorowych (H+) wiąże się z jonami wodorowęglanowymi (HCO3–) tworząc stan równowagi z kwasem węglowym (H2CO3). Jeśli kwas węglowy zostanie dodany do tego układu, część z niego zostanie przekształcona w jony wodorowęglanowe i wodorowe.
HCO3– + H+ ↔ H2CO3
w reakcjach biologicznych równowaga jest jednak rzadko uzyskiwana, ponieważ stężenia reagentów lub produktów lub obu tych reakcji stale się zmieniają, często przy czym produkt jednej reakcji jest reagentem dla innej. Aby powrócić do przykładu nadmiaru jonów wodorowych we krwi, głównym kierunkiem reakcji będzie tworzenie kwasu węglowego. Jednak kwas węglowy może również opuścić ciało jako gazowy dwutlenek węgla (poprzez wydech) zamiast przekształcać się z powrotem w jon wodorowęglanowy, prowadząc w ten sposób reakcję w prawo chemiczne znane jako prawo działania masy. Reakcje te są ważne dla utrzymania homeostazy naszej krwi.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
w podsumowaniu: Reakcje chemiczne i cząsteczki
zewnętrzna powłoka elektronowa dyktuje, jak łatwo i jakiego rodzaju wiązania chemiczne tworzy dany atom. Tworzenie związków jest często wizualnie przedstawione w równaniach chemicznych, które pokazują reagenty biorące udział w reakcjach chemicznych do tworzenia produktów.
spróbuj
popraw tę stronęucz się więcej
Leave a Reply