3.4: Rutherford’ s Experiment – the Nuclear Model of the Atom
Atoms and Gold
w 1911 roku Rutherford i współpracownicy Hans Geiger i Ernest Marsden zainicjowali serię przełomowych eksperymentów, które całkowicie zmieniłyby przyjęty model atomu. Bombardowali bardzo cienkie arkusze złotej folii szybko poruszającymi się cząsteczkami Alfa.

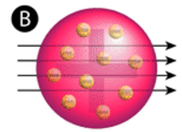

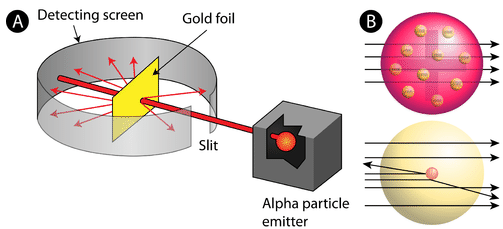
rysunek \(\PageIndex{2}\) (a) konfiguracja eksperymentalna dla eksperymentu Rutherforda ze złotą folią: pierwiastek promieniotwórczy, który emitował cząstki alfa, został skierowany w stronę cienkiego arkusza złotej folii, który był otoczony ekranem, który umożliwiał wykrycie odchylonych cząstek. (B) zgodnie z modelem puddingu śliwkowego (Góra) wszystkie cząstki alfa powinny przejść przez złotą folię z niewielkim lub żadnym ugięciem. Rutherford odkrył, że niewielki procent cząstek alfa były odchylane pod dużymi kątami, co można wyjaśnić atomem z bardzo małym, gęstym, dodatnio naładowanym jądrem w centrum (na dole).
zgodnie z przyjętym modelem atomowym, w którym masa i ładunek atomu są równomiernie rozłożone w całym atomie, naukowcy spodziewali się, że wszystkie cząstki alfa przejdą przez złotą folię z tylko niewielkim odchyleniem lub wcale. Zaskakująco, jak pokazano na rysunku \(\PageIndex{2}\) (podczas gdy większość cząstek alfa była rzeczywiście niezabezpieczona, bardzo mały procent (około 1 na 8000 cząstek) odbił się od złotej folii pod bardzo dużymi kątami. Niektóre zostały nawet przekierowane z powrotem do źródła. Żadna wcześniejsza wiedza nie przygotowała ich do tego odkrycia. W słynnym cytacie Rutherford wykrzyknął, że to było „jakbyś wystrzelił 15-calową skorupę w kawałek tkanki i wrócił i uderzył cię.”
Rutherford musiał wymyślić zupełnie nowy model atomu, aby wyjaśnić swoje wyniki. Ponieważ zdecydowana większość cząstek alfa przeszła przez złoto, uznał, że większość atomu jest pustą przestrzenią. W przeciwieństwie do tego, cząstki, które były mocno odchylone musiały doświadczyć ogromnie potężnej siły wewnątrz atomu. Doszedł do wniosku, że cały ładunek dodatni i większość masy atomu musi być skoncentrowana w bardzo małej przestrzeni we wnętrzu atomu, którą nazwał jądrem. Jądro jest małym, gęstym, centralnym jądrem atomu i składa się z protonów i neutronów.
model atomowy Rutherforda stał się znany jako model atomowy. W atomie jądrowym protony i neutrony, które stanowią prawie całą masę atomu, znajdują się w jądrze w centrum atomu. Elektrony są rozmieszczone wokół jądra i zajmują większość objętości atomu. Warto podkreślić, jak małe jest jądro w porównaniu do reszty atomu. Gdybyśmy mogli wysadzić atom wielkości dużego profesjonalnego stadionu piłkarskiego, jądro byłoby wielkości marmuru.
model Rutherforda okazał się ważnym krokiem w kierunku pełnego zrozumienia atomu. Jednak nie całkowicie zająć naturę elektronów i sposób, w jaki zajmują ogromną przestrzeń wokół jądra. Za te i inne spostrzeżenia Rutherford otrzymał w 1908 roku Nagrodę Nobla w dziedzinie chemii. Niestety, Rutherford wolałby otrzymać Nagrodę Nobla w dziedzinie fizyki, ponieważ uważał fizykę za lepszą od chemii. Jego zdaniem ” cała nauka to albo fizyka, albo kolekcjonowanie znaczków.”
Leave a Reply