Transitiemetaal
Er zijn een aantal eigenschappen gedeeld door de transitie-elementen die niet in andere elementen worden gevonden, die het resultaat zijn van de gedeeltelijk gevulde D-shell. Deze omvatten
- de vorming van verbindingen waarvan de kleur te wijten is aan D–d elektronische overgangen
- de vorming van verbindingen in vele oxidatietoestanden, als gevolg van de relatief lage energiekloof tussen verschillende mogelijke oxidatietoestanden
- de vorming van vele paramagnetische verbindingen als gevolg van de aanwezigheid van ongepaarde d-elektronen. Een paar verbindingen van hoofdgroepelementen zijn ook paramagnetisch (bijv. stikstofmonoxide, zuurstof)
De meeste overgangsmetalen kunnen worden gebonden aan een verscheidenheid aan liganden, waardoor een grote verscheidenheid aan overgangsmetaalcomplexen mogelijk is.
Gekleurde verbindingen

3)
2 (rood); K
2Cr
2O
7 (oranje); K
2CrO
4 (geel); NiCl
2 (turquoise); CuSO
4 (blauw); KMnO
4 (paars).
kleur in transitieseries metaalverbindingen is over het algemeen het gevolg van elektronische overgangen van twee hoofdtypen.
- ladingsovergangen. Een elektron kan van een overwegend ligand-orbitaal naar een overwegend metaal-orbitaal springen, wat leidt tot een ligand-op-metaal-charge-transfer (LMCT) – overgang. Deze kunnen het gemakkelijkst optreden wanneer het metaal zich in een hoge oxidatietoestand bevindt. Bijvoorbeeld, de kleur van chromaat, dichromaat en permanganaationen is toe te schrijven aan lmct-overgangen. Een ander voorbeeld is dat mercurisch jodide, HgI2, rood is vanwege een lmct overgang.
een metaal-naar-ligand charge transfer (MLCT) overgang zal het meest waarschijnlijk zijn wanneer het metaal in een lage oxidatietoestand is en de ligand gemakkelijk verminderd is.
in het algemeen resulteren ladingovergangen in intensere kleuren dan D-d overgangen.
- D-d overgangen. Een elektron springt van de ene d-orbitaal naar de andere. In complexen van de overgangsmetalen hebben de d-orbitalen niet allemaal dezelfde energie. Het splitsingspatroon van de d-orbitalen kan worden berekend met behulp van de kristalveldtheorie. De omvang van de splitsing hangt af van het specifieke metaal, de oxidatietoestand en de aard van de liganden. De werkelijke energieniveaus worden weergegeven op Tanabe-Sugano diagrammen.
in centrosymmetrische complexen, zoals octaëdrische complexen, zijn D-d-overgangen verboden door de Laporte-regel en komen alleen voor door vibronische koppeling waarbij een moleculaire trilling samen met een D-d-overgang optreedt. Tetraëdrische complexen hebben iets intensere kleur omdat menging van D-en p-orbitalen mogelijk is wanneer er geen centrum van symmetrie is, dus overgangen zijn geen zuivere D-d overgangen. De molaire absorptie (ε) van banden veroorzaakt door D-d overgangen zijn relatief laag, ongeveer in het bereik 5-500 M−1cm−1 (waarbij m = mol dm−3). Sommige D-d overgangen zijn spin verboden. Een voorbeeld komt voor in octaëdrische, hoogspincomplexen van mangaan (II), die een D5-configuratie hebben waarin alle vijf elektronen parallelle spins hebben; de kleur van dergelijke complexen is veel zwakker dan in complexen met spin-toegestane overgangen. Veel verbindingen van mangaan (II) lijken bijna kleurloos. Het spectrum van 2 +
toont een maximale Molaire absorptie van ongeveer 0,04 M-1cm-1 in het zichtbare spectrum.
oxidatietoestanden
een kenmerk van overgangsmetalen is dat zij twee of meer oxidatietoestanden vertonen, die gewoonlijk één van elkaar verschillen. Vanadium-verbindingen zijn bijvoorbeeld bekend in alle oxidatietoestanden tussen -1, zoals –
, en +5, zoals VO3 –
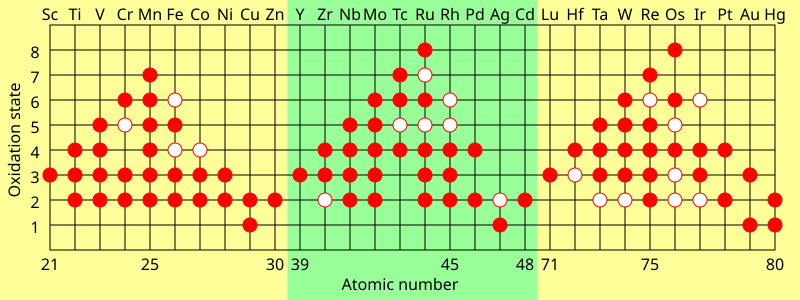
Hoofdgroep-elementen in de groepen 13 tot en met 18 vertonen ook meerdere oxidatietoestanden. De” gemeenschappelijke ” oxidatietoestanden van deze elementen verschillen meestal door twee in plaats van één. Bijvoorbeeld, verbindingen van gallium in oxidatietoestanden +1 en + 3 bestaan waarin er één enkel galliumatoom is. Er is geen verbinding van Ga(II) bekend: een dergelijke verbinding zou een ongepaarde elektron hebben en zich als vrije radicalen gedragen en snel worden vernietigd. De enige verbindingen waarin gallium een formele oxidatietoestand van +2 heeft, zijn dimere verbindingen, zoals 2-
, die een Ga-Ga-binding bevatten die wordt gevormd door het ongepaarde elektron op elk ga-atoom. Dus het belangrijkste verschil in oxidatietoestanden, tussen overgangselementen en andere elementen is dat oxidatietoestanden bekend zijn waarin er een enkel atoom van het element en een of meer ongepaarde elektronen.
De maximale oxidatietoestand in de eerste rij overgangsmetalen is gelijk aan het aantal valentie-elektronen van titaan (+4) tot mangaan (+7), maar neemt af in de latere elementen. In de tweede rij treedt het maximum op met ruthenium (+8), en in de derde rij treedt het maximum op met iridium (+9). In verbindingen zoals –
en OsO
4 bereiken de elementen een stabiele configuratie door covalente binding.
De laagste oxidatietoestanden worden tentoongesteld in metaalcarbonylcomplexen zoals Cr(CO)
6 (oxidatietoestand nul) en 2−
(oxidatietoestand -2) waarin de 18-elektronregel wordt nageleefd. Deze complexen zijn ook covalent.
Ionverbindingen worden meestal gevormd met oxidatietoestanden +2 en + 3. In waterige oplossing, worden de ionen gehydrateerd door (gewoonlijk) zes watermoleculen die octaëdraal worden gerangschikt.
magnetisme
Transitiemetaalverbindingen zijn paramagnetisch wanneer ze een of meer ongepaarde d-elektronen hebben. In octaëdrische complexen met tussen de vier en zeven d-elektronen zijn zowel hoge spin-als lage spintoestanden mogelijk. Tetraëdrische overgangsmetaalcomplexen zoals 2-
hebben een hoge spin omdat de splitsing van het kristalveld klein is, zodat de energie die verkregen kan worden doordat de elektronen in orbitalen met een lagere energie zitten altijd minder is dan de energie die nodig is om de spins te koppelen. Sommige verbindingen zijn diamagnetisch. Deze omvatten octaëdrale, low-spin, d6 en vierkant-vlakke D8 complexen. In deze gevallen is de splitsing van het kristalveld zodanig dat alle elektronen worden gekoppeld.
ferromagnetisme treedt op wanneer individuele atomen paramagnetisch zijn en de spinvectoren parallel aan elkaar zijn uitgelijnd in een kristallijn materiaal. Metallisch ijzer en de legering alnico zijn voorbeelden van ferromagnetische materialen met overgangsmetalen. Anti-ferromagnetisme is een ander voorbeeld van een magnetische eigenschap die voortvloeit uit een bepaalde uitlijning van individuele spins in de vaste toestand.
katalytische eigenschappen
De overgangsmetalen en hun verbindingen staan bekend om hun homogene en heterogene katalytische activiteit. Deze activiteit wordt toegeschreven aan hun vermogen om meerdere oxidatietoestanden aan te nemen en complexen te vormen. Vanadium (V) oxide (in het contactproces), fijn verdeeld ijzer (in het Haber-proces), en nikkel (in katalytische hydrogenering) zijn enkele van de voorbeelden. Katalysatoren op een vast oppervlak (op nanomateriaal gebaseerde katalysatoren) omvatten de vorming van bindingen tussen reactantmoleculen en atomen van het oppervlak van de katalysator (eerste rij overgangsmetalen gebruiken 3d en 4S elektronen voor binding). Dit heeft het effect van het verhogen van de concentratie van de reagentia aan het katalysatoroppervlak en ook verzwakking van de bindingen in de reagerende moleculen (de activeringsenergie wordt verlaagd). Ook omdat de overgangsmetaalionen hun oxidatietoestanden kunnen veranderen, worden ze effectiever als katalysatoren.
een interessant type katalyse vindt plaats wanneer de producten van een reactie de reactie katalyseren die meer katalysator produceert (autokatalyse). Een voorbeeld hiervan is de reactie van oxaalzuur met aangezuurd kaliumpermanganaat (of manganaat (VII)). Zodra een beetje Mn2+ is geproduceerd, kan het reageren met MnO4-vormende Mn3+. Dit reageert dan met C2O4-ionen die opnieuw MN2+ vormen.
fysische eigenschappen
zoals de naam aangeeft, zijn alle overgangsmetalen metalen en dus geleiders van elektriciteit.
in het algemeen hebben overgangsmetalen een hoge dichtheid en hoge smelt-en kookpunten. Deze eigenschappen zijn te wijten aan metaalbinding door gedelokaliseerde d-elektronen, wat leidt tot samenhang die toeneemt met het aantal gedeelde elektronen. De metalen van groep 12 hebben echter veel lagere smelt-en kookpunten, omdat hun volledige d–subschalen D-d-binding voorkomen, waardoor ze opnieuw worden onderscheiden van de geaccepteerde overgangsmetalen. Kwik heeft een smeltpunt van -38,83 °C (-37,89 ° F) en is een vloeistof bij kamertemperatuur.
Leave a Reply