NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Zij worden gebruikt bij de vervaardiging van spuitbussen, blaasmiddelen voor schuim en verpakkingsmateriaal, als oplosmiddelen en als koelmiddelen. CFK ‘ s worden geclassificeerd als halogeenverbindingen, een klasse van verbindingen die koolstofatomen en halogeenatomen bevatten. De individuele CFC molecules worden geëtiketteerd met een uniek nummeringssysteem. Bijvoorbeeld, geeft het CFC-nummer van 11 het aantal atomen van koolstof, waterstof, fluor, en chloor aan (b. v. CCl3F als CFC-11). De beste manier om het systeem te onthouden is de “regel van 90” of voeg 90 toe aan het CFC-nummer waar het eerste cijfer het aantal koolstofatomen (C) is, het tweede cijfer het aantal waterstofatomen (H), en het derde cijfer het aantal fluoratomen (F). Het totale aantal chlooratomen (Cl) wordt berekend door de uitdrukking: Cl = 2(C+1) – H – F. in het voorbeeld heeft CFC-11 één koolstof, geen waterstof, één fluor, en dus 3 chlooratomen.
koelkasten in de late jaren 1800 en vroege jaren 1900 gebruikt de giftige gassen, ammoniak (NH3), methylchloride (CH3Cl), en zwaveldioxide (SO2), als koelmiddelen. Na een reeks dodelijke ongevallen in de jaren 1920 toen methylchloride uit koelkasten lekte, begon een zoektocht naar een minder giftige vervanging als een gezamenlijke inspanning van drie Amerikaanse bedrijven – Frigidaire, General Motors en Du Pont. CFK ‘ s werden voor het eerst gesynthetiseerd in 1928 door Thomas Midgley, Jr.van General Motors, als veiliger chemicaliën voor koelkasten die in grote commerciële toepassingen worden gebruikt1. Frigidaire kreeg het eerste patent, nummer 1.886.339, voor de formule voor CFK ‘ s op 31 December 1928. In 1930 richtten General Motors en Du Pont de Kinetic Chemical Company op om in grote hoeveelheden Freon (een handelsnaam van Du Pont voor CFK ‘ s) te produceren. In 1935 hadden Frigidaire en zijn concurrenten 8 miljoen nieuwe koelkasten in de Verenigde Staten verkocht met behulp van Freon-12 (CFC-12) gemaakt door de Kinetic Chemical Company en de bedrijven die een vergunning hadden om deze verbinding te produceren. In 1932 gebruikte de Carrier Engineering Corporation Freon-11 (CFC-11) in ‘ s werelds eerste op zichzelf staande airconditioner voor thuis, de zogenaamde “Atmosferische kast”.; Vanwege het CFC-veiligheidsrecord voor niettoxiciteit, werd Freon het favoriete koelmiddel in grote airconditioningsystemen. De volksgezondheidscodes in veel Amerikaanse steden werden herzien om Freon aan te duiden als het enige koelmiddel dat in openbare gebouwen kon worden gebruikt. Na de Tweede Wereldoorlog werden CFK ‘ s gebruikt als drijfgas voor insectensprays, verven, haarconditioners en andere gezondheidsproducten. Eind jaren vijftig en begin jaren zestig maakten de CFK ’s een goedkope oplossing mogelijk voor het verlangen naar airconditioning in veel auto’ s, woningen en kantoorgebouwen. Later nam de groei van het gebruik van CFK ’s wereldwijd toe met een piek, een jaarlijkse omzet van ongeveer een miljard dollar (VS) en meer dan een miljoen ton geproduceerde CFK’ s.
terwijl CFK ‘ s in de meeste toepassingen veilig zijn en inert zijn in de lagere atmosfeer, ondergaan ze een significante reactie in de hogere atmosfeer of stratosfeer. In 1974, twee University of California chemists, Professor F. Sherwood Rowland en Dr. Mario Molina toonde aan dat de CFK ‘ s een belangrijke bron van anorganisch chloor in de stratosfeer kunnen zijn na hun fotolytische ontleding door UV-straling. Bovendien zou een deel van het vrijgekomen chloor actief worden om ozon in de stratosfeer te vernietigen2. Ozon is een spoorgas dat zich voornamelijk in de stratosfeer bevindt (zie ozon). Ozon absorbeert schadelijke ultraviolette straling in de golflengten tussen 280 en 320 nm van de UV-B-band die biologische schade kan veroorzaken bij planten en dieren. Een verlies van stratosferische ozon resulteert in schadelijkere UV-B-straling die het aardoppervlak bereikt. Chloor dat vrijkomt uit CFK ‘ s vernietigt ozon in katalytische reacties waarbij 100.000 moleculen ozon per chlooratoom kunnen worden vernietigd.
een grote depletie van stratosferisch ozon in het voorjaar werd elk volgend jaar erger. Dit ozonverlies werd in 1985 beschreven door de Britse onderzoeker Joe Farman en zijn collega ‘ S3. Het werd genoemd de Antarctische ozon holeî door anderen. Het ozongat was anders dan het ozonverlies op de middelste breedtegraden. Het verlies was groter over Antarctica dan de midlatitudes als gevolg van vele factoren: de ongewoon koude temperaturen van het gebied, de dynamische isolatie van deze iholeî en de synergetische reacties van chloor en bromine4. Het ozonverlies is ook toegenomen in de poolgebieden als gevolg van reacties met polaire stratosferische wolken (PSCs)5 en in het midden van de breedtegraden na vulkaanuitbarstingen. De noodzaak om de CFK ‘ s te controleren werd dringend. in 1987 ondertekenden 27 landen een wereldwijd milieuverdrag, het Protocol van Montreal ter vermindering van stoffen die de ozonlaag afbreken 6, waarin werd bepaald dat de productie van deze stoffen in 1986 vóór het jaar 2000 met 50% moest worden verminderd. Deze internationale overeenkomst bevatte beperkingen op de productie van CFK ‘ s-11, -12, -113, -114, -115, en de Halonen (chemicaliën die als brandblusmiddelen worden gebruikt). Een amendement dat in 1990 in Londen werd goedgekeurd, was krachtdadiger en riep op tot afschaffing van de productie tegen het jaar 2000. De gechloreerde oplosmiddelen, methylchloroform (CH3CCl3) en tetrachloorkoolstof (CCl4) werden toegevoegd aan het amendement van Londen.
grote hoeveelheden reactief stratosferisch chloor in de vorm van chloormonoxide (ClO) die alleen het gevolg konden zijn van de vernietiging van ozon door de CFK ’s in de stratosfeer werden waargenomen door instrumenten aan boord van de NASA er-2 vliegtuigen en UARS (Upper Atmospheric Research Satellite) over enkele regio’ s in Noord-Amerika in de winter van 199278. De milieuzorg voor CFK ‘ s vloeit voort uit hun lange atmosferische levensduur (55 jaar voor CFK-11 en 140 jaar voor CFK-12, CCl2F2)9, die ons vermogen beperkt om hun abundantie in de atmosfeer en het daarmee samenhangende toekomstige ozonverlies te verminderen. Dit resulteerde in het amendement van Kopenhagen dat de productie verder beperkte en later in 1992 werd goedgekeurd. De productie van deze chemicaliën eindigde voor het grootste deel op 1 januari 1996. De enige goedgekeurde uitzonderingen waren voor de productie in ontwikkelingslanden en voor enkele vrijgestelde toepassingen in de geneeskunde (d.w.z. astma-inhalatoren) en onderzoek. Het Protocol van Montreal bevatte handhavingsbepalingen door economische en handelsstraffen toe te passen indien een ondertekenende land deze verboden chemische stoffen verhandelt of produceert. In totaal hebben 148 landen het Protocol van Montreal ondertekend. Uit de in 1993 gerapporteerde atmosferische metingen van CFC-11 en CFC-12 is gebleken dat hun groeicijfers daalden als gevolg van zowel vrijwillige als verplichte emissiereducties 9. Veel CFK ‘ s en geselecteerde gechloreerde oplosmiddelen zijn in 1994 afgevlakt (figuur 1) of zijn in concentratie gedaald (10).
de vraag naar CFK ’s werd opgevangen door recycling en hergebruik van bestaande voorraden CFK’ s en door het gebruik van vervangingsmiddelen. Sommige toepassingen, bijvoorbeeld het ontvetten van metalen en het reinigen van oplosmiddelen voor printplaten, die ooit CFK ‘ s gebruikten, gebruiken nu halocarbonvrije vloeistoffen, water (soms als stoom) en verdunde citroenzuren. De industrie ontwikkelde twee klassen van halocarbonvervangers-de chloorfluorkoolwaterstoffen (HCFK ‘s) en de fluorkoolwaterstoffen (HFK’ s). HCFK ‘ s omvatten waterstofatomen naast chloor, fluor en koolstofatomen. Het voordeel van HCFK ‘ s is dat de waterstof reageert met troposferische hydroxyl (OH), wat resulteert in een kortere atmosferische levensduur. HCFK-22 (CHClF2) heeft een atmosferische levensduur van ongeveer 13 jaar11 en wordt sinds 1975 gebruikt in klimaatregelings-en koeltoepassingen. HCFK ‘ s bevatten echter nog steeds chloor, waardoor ze ozon kunnen vernietigen. In het amendement van Kopenhagen wordt gevraagd om de productie ervan tegen het jaar 2030 te beëindigen. De HFK ‘ s worden beschouwd als een van de beste substituten voor het verminderen van ozonverlies in de stratosfeer vanwege hun korte levensduur en gebrek aan chloor. In de Verenigde Staten, wordt HFC-134a gebruikt in alle nieuwe binnenlandse auto airconditioners. Zo groeit HFK-134a in 1995 snel met een groei van ongeveer 100% per jaar en een atmosferische levensduur van ongeveer 12 jaar12. (De “regel van 90” geldt ook voor de chemische formule van HCFK ’s en HFK’ s.)
het gebruik van CFK ‘ s, sommige gechloreerde oplosmiddelen en Halonen zou in de komende tien jaar overbodig moeten worden als het Protocol van Montreal door alle partijen wordt nageleefd en er vervangingsmiddelen worden gebruikt. De wetenschap die de basis werd voor het Protocol van Montreal resulteerde in de Nobelprijs voor de Scheikunde in 1995. De prijs werd gezamenlijk toegekend aan professoren F. S. Rowland aan de Universiteit van Californië te Irvine, M. Molina aan het Massachusetts Institute of Technology te Cambridge, en Paul Crutzen aan het Max-Planck-Institute for Chemistry in Mainz, Duitsland, voor hun werk op het gebied van de atmosferische chemie, in het bijzonder met betrekking tot de vorming en afbraak van ozon (in het bijzonder door CFK ‘ s en stikstofoxiden).
1Midgley, T., and Henne, A., Organic fluorides as refrigerants, Industrial and Engineering Chemistry, 22, 542-547, 1930.
2Molina, M. J., and F. S. Rowland, Stratosferic sink for chlorofluormethanes: Chlorine atom catalyzed destruction of ozon, Nature, 249, 810-814, 1974. 3farman, J. C., B. G. Gardiner, and J. D. Shanklin, Large losses of total ozone in Antarctica reveal seasonal ClOx / NOx interaction, Nature, 315.207-210, 1985.
4McElroy, M. B., R. J. Salawitch, S. C. Wofsy, and J. A. Logan, Reductions of Antarctic ozone due to synergistic interactions of chloor and bromine, Nature, 321, 759-762, 1986. 5solomon, S., R. R. Garcia, F. S. Rowland, and D. J. Wuebbles, On the depletion of Antarctic ozone, Nature, 321, 755-758, 1986.
6Montreal Protocol on Substances that Deplete the Ozone Layer, 15 pp, United Nations Environmental Programme (UNEP), New York, 1987. 7Toohey, D. W., L. M. Avallone, L. R. Lait, P. A. Newman, M. R. Schoeberl, D. W. Fahey, E. L. Woodbridge, and J. G. Anderson, The seasonal evolution of reactive chlorine in the northern hemisphere stratosphere, Science, 261, 1134-1136, 1993. 8waters, J., L. Froidevaux, W. Read, G. Manney, L..Elson, D. Flower, R. Jarnot, en R. Harwood, Stratosferic ClO andozone from the Microwave Limb Sounder on the Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9Elkins, J. W. T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher en A. G. Raffo, een Daling in de groei van de atmosferische chloorfluorkoolstoffen 11 en 12, Natuur, 364 , 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Huang, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley, en P. G. Simmonds, Sfeervolle trends en levens van CH3CCl3 en wereldwijde OH concentraties, Wetenschap, 269, 187-192, 1995. 11Montzka, S. A., R. C. Myers, J. H. Butler, S. C. Cummings, and J. W. Elkins, Global troposferic distribution and calibration scale of HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12Montzka, S. A., R. C. Myers, J. H. Butler, J. W. Elkins, L. T. Lock, A. D. Clarke, and A. H. Goldstein, Observations of HFC-134a in the remote troposhere, Geophysical Research Letters, 23, 169-172, 1996.
Suggested Additional Reading:
Cagin, S., and P. Dray, Between Earth and Sky: How CFK ‘ s changed our world and threatened the ozone layer, 512 blz., Pantheon Press, New York, 1993.
Scientific Assessment of Ozone Depletion: 1994, edited by D. L. Albritton, R. T. Watson, and R. J. Aucamp, 37, 451 pp., World Meteorological Organization (WMO), Genève, 1995.
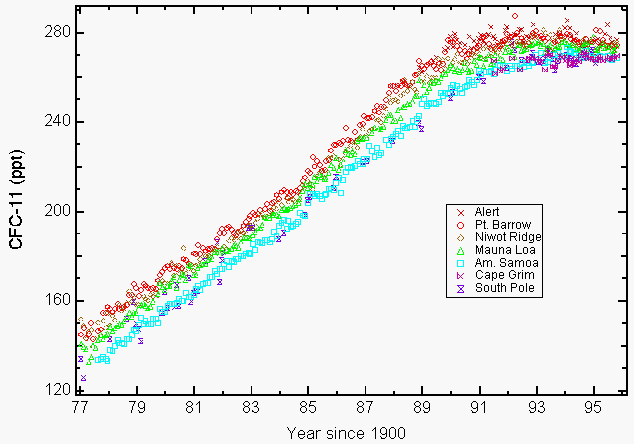
figuur 1: de accumulatie van chloorfluorkoolstof-11 (CFC-11) in de atmosfeer als gevolg van vrijwillige en verplichte emissiereducties. Maandelijkse gemiddelden gerapporteerd als droge mengverhoudingen in delen per biljoen (ppt) voor CFC-11 op grondniveau voor vier NOAA/CMDL-stations (Pt. Barrow, Alaska; Mauna Loa, Hawaii; Cape Matatula, Amerikaans-Samoa en Zuidpool) en drie coöperatieve stations (Alert, Northwest Territories, Canada (Atmospheric Environment Service); Niwot Ridge, Colorado (University of Colorado); Cape Grim Baseline Air Pollution Station, Tasmanië, Australië (Commonwealth Scientific and Industrial Research Organization)9. (Met dank aan NOAA / CMDL)
Leave a Reply