natriumhydroxide
natriumhydroxide chemische eigenschappen,Gebruik,productie
chemische eigenschappen
natriumhydroxide is een wit, reukloos, niet-vluchtig alkalisch materiaal dat in vaste vorm in de handel wordt gebracht als pellets, vlokken, klontjes of sticks. De oplosbaarheid in water bedraagt 111 gewichtsprocent en een dampdruk van 0mmHg (NIOSH, 1994).
Het kan reageren met tricholoethyleen (TCE) om brandbaar dichlooracetyleen te vormen en met metalen om waterstofgas te vormen (OEHHA, 1993). De reactiviteit met metalen moet worden overwogen met betrekking tot opslageenheden en containers.
natriumhydroxide is algemeen verkrijgbaar als een waterige oplossing bekend als bijtende soda, natronloog of eenvoudig als loog. Het heeft verschillende toepassingen, met inbegrip van neutralisatie van zuur; de vervaardiging van papier, textiel, kunststoffen, corrosieve stoffen, kleurstoffen, verf, verf remover, en zeep; raffinage van aardolie; galvaniseren; metaal reinigen; witwassen; en afwasmiddel. Een groeiend gebruik is in de illegale productie van methamfetamine geweest.
gebruikt
natriumhydroxide (NaOH) is een van de meest bruikbare industriële natriumverbindingen. Het is ook bekend als loog of bijtende soda en is een van de sterkste Base alkaliën (hoge pH-waarde)op de huishoudelijke markt. Het wordt gebruikt als afvoer-en ovenreiniger en verzuurt vetten in de productie van zeep. Het moet met zorg worden gebruikt omdat het ook ernstige huidbrandwonden kan veroorzaken.
omschrijving
natriumhydroxide, ook bekend als loog en bijtende soda, is een sterk bijtende stof die in kleine hoeveelheden in cosmetica wordt gebruikt om de pH van een product vast te stellen en vast te houden.Natriumhydroxide is een uiterst belangrijke verbinding in ons leven omdat het zoveel toepassingen heeft. Het is een veel voorkomende basis gebruikt in de chemische industrie en wordt gebruikt voor veel dingen, waarvan vele in ons dagelijks leven. Een van de meest bekende toepassingen van natriumhydroxide is het gebruik ervan in het ontstoppen van afvoeren. Het komt in veel verschillende merken van afvoerreinigers, maar een van de meest voorkomende is Drano. Het komt ook in de vorm van loog zeep die kan worden gebruikt om vrijwel alles te wassen, van de gerechten tot je gezicht.
natriumhydroxidestructuur
bij kamertemperatuur is natriumhydroxide een witte kristallijne geurloze vaste stof die vocht uit de lucht absorbeert. Het is een gefabriceerde stof. Natriumhydroxide is een anorganische verbinding die wordt gebruikt om de pH-waarden te regelen of dient als buffermiddel in cosmetica en persoonlijke verzorgingsproducten. Het werd historisch gebruikt in de formulering van zepen, maar wordt momenteel gezien in een verscheidenheid van formules, waaronder badproducten, reinigingsproducten, geuren, voetpoeders, haarkleurmiddelen en kleuren, make-up, nagelproducten, persoonlijke reinheidsproducten, shampoos, Scheerproducten, Ontharingsmiddelen, huidverzorgingsproducten en zonnebrandproducten, evenals chemische stijltangen en haargolfsets. Het is ook een populair ingrediënt in industriële oplosmiddelen als een chemische basis voor zepen, ovenreinigers, detergenten en afvoerreinigers vanwege zijn vermogen om vet, oliën, vetten en eiwit gebaseerde afzettingen op te lossen, volgens Wikipedia. Minder vaak wordt natriumhydroxide gezien als een ingrediënt in tandpasta ‘ s.
natriumhydroxide is goedgekeurd door de FDA en heeft de GRAS-classificatie (algemeen erkend als veilig) gekregen als een direct levensmiddelenadditief. Echter, het wordt voornamelijk gebruikt in het wassen en chemische peeling van producten. Het is goedgekeurd voor gebruik in cosmetica en producten voor persoonlijke verzorging in verschillende concentraties: 5 gewichtsprocent in oplosmiddelen voor nagelschubben, 2 gewichtsprocent in stijltangen voor algemeen gebruik, 4,5 gewichtsprocent in stijltangen voor professioneel gebruik, tot een pH 12,7 in Ontharingsmiddelen en tot pH 11 in andere toepassingen als pH-regelaar.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
chemische eigenschappen
natriumhydroxide, NaOH,ook bekend als bijtende soda of natriumhydraat(en voorheen bekend als loog), is een witte,massieve, vervloeiende kristallijne vaste stof die oplosbaar is in water,alcohol en glycerol. Het smelt bij 318°C (606 OF) en is de meest gebruikte en beschikbare alkalische chemische stof. De meeste natriumhydroxide wordt geproduceerd als een coproduct van chloor door het gebruik van elektrolytische cellen;de cellen zijn van het diafragma, kwik, of membraan type. Sommige natriumhydroxide wordt gemerkt als geproduceerd in de cellen;de meeste wordt verdampt en verkocht als 50% – en 73% – oplossing of als watervrije parels. De meeste bijtende eindtoepassingen vereisen oplossingen van relatief lage concentraties. Bijtende soda wordt gebruikt als analytisch reagens en chemisch tussenproduct, in schuurbaden en reinigingsbaden,in rubberterugwinning en aardolieraffinage, in blusbaden voor de warmtebehandeling van staal,in snij-en oplosbare oliën,in zeep en detergenten en in een breed scala aan andere toepassingen.
chemische eigenschappen
NaOH is een wit, reukloos, vervloeiend materiaal dat wordt verkocht als pellets, vlokken, klontjes of sticks. Waterige oplossingen worden natronloog
chemische eigenschappen
natriumhydroxide komt voor als een witte of bijna witte gesmolten massa. Het is verkrijgbaar in kleine pellets, vlokken, stokken en andere vormen of vormen. Het is hard en broos en vertoont een kristallijne breuk. Sodiumhydroxide is zeer vervloeiend en bij blootstelling aan lucht absorbeert het snel kooldioxide en water.
Fysische eigenschappen
Wit orthorhombische kristallen, geproduceerd in de vorm van korrels, brokken, stokken, kralen, chips, vlokken of oplossingen; hygroscopisch; zeer corrosief; snel absorbeert CO2 en water uit de lucht; dichtheid 2.13 g/cm3; smelt 323°C, verdampt in 1388°C; dampspanning 1 torr op 739°C en 5 torr bij 843°C; zeer goed oplosbaar in water (110 g/100 ml op kamertemperatuur), het genereren van warmte op ontbinding; waterige oplossingen sterk alkalisch, pH van een 0,5% oplossing over 13 en 0,05% – oplossing over 12; oplosbaar in methanol, ethanol en glycerol (23.8 g/100 mL methanol en 13.9 g / 100 mL ethanol bij omgevingstemperatuur.).
gebruikt
natronloog is een van de meest gebruikte chemische stoffen. Het wordt gebruikt om zuren te neutraliseren; natriumzouten te maken; metalen neer te slaan als hun hydroxiden; bij aardolieraffinage; bij de afzetting van esters; bij de behandeling van cellulose, kunststoffen en rubber; en in talrijke synthetische en analytische toepassingen.
gebruik
natriumhydroxide wordt in de handel verkocht als watervrije vlokken of pellets of als 50% – of 73% – oplossing in water. Het heeft talloze industriële toepassingen en is een van de top 10 chemische in termen van productie en gebruik op wereldwijde schaal. Jaarlijks wordt ongeveer 15 miljoen ton natriumhydroxide gebruikt. Het grootste gebruik, dat ongeveer de helft van zijn productie verbruikt, is als basis voor de productie van andere chemicaliën. Het wordt gebruikt om pH te controleren en zuren in chemische processen te neutraliseren. De papierindustrie maakt in het verpulpproces veelvuldig gebruik van natriumhyoxide. Natriumhydroxide wordt gebruikt om vezels te scheiden door het verbindende lignine op te lossen. Het wordt op soortgelijke wijze gebruikt bij de productie van rayon uit cellulose. Natriumhydroxide is een belangrijke chemische stof in de zeep industry.In het verzepingsproces, triglyceriden verkregen uit dieren en planten worden verhit in een basische oplossing tot glycerol en zeep:
natriumhydroxide wordt gebruikt in de textielindustrie voor het bleken en behandelen van textiel om deze gemakkelijker te verven. De aardolie-industrie gebruikt natriumhydroxide in boorgruis en asa-bactericide. Natriumhypochloriet (NaOCl) wordt veelvuldig gebruikt voor reiniging en als ontsmettingsmiddel.Gemeenschappelijke huishoudelijke bleekmiddel bestaat uit ongeveer 5% natriumhypochloriet oplossing. Sodiumhypochloriet wordt bereid door chloor te reageren met natriumhydroxide: Cl2(g) + 2NaOH(aq) →NaOCl(aq) + NaCl(aq) + H2O (l). Natriumhydroxide wordt gebruikt in de voedingsindustrie voor het reinigen en schillen van groenten en fruit. Natriumhydroxide is een minder belangrijk ingrediënt in veel gewone huishoud producten, maar in een paar kan het meer dan de helft van het product. Dranocrystals bevatten tussen 30% en 60% natriumhydroxide en sommige afvoerreinigers kunnen bestaan uit 100% natriumhydroxide.
gebruik
natriumhydroxide is een alkali die oplosbaar is in water, met een oplosbaarheid van 1 g in 1 ml water. het wordt gebruikt om de bittere chemicaliën in olijven te vernietigen die zwarte olijven zullen worden. het werkt ook om zuren in verschillende voedingsmiddelen te neutraliseren.
gebruik
natriumhydroxide wordt gebruikt om de pH van een product aan te passen om het voor de huid acceptabeler te maken. Het wordt vaak aangeduid als bijtende soda, en dient vaak als een chemisch reagens bij het maken van zeep. Als het te geconcentreerd is, kan het ernstige huidirritatie veroorzaken.
gebruik
natriumhydroxide is een van de belangrijkste industriële chemicaliën. In volume, het is in de top tien chemicaliën geproduceerd in de Verenigde Staten. Het wordt gebruikt in de productie van een groot aantal verbindingen, waaronder verschillende natriumzouten, in de behandeling van cellulose voor de productie van rayon en cellofaan, en in de productie van zeep, detergenten, pulp en papier. Natriumhydroxide is een veel voorkomende neutraliserende agent voor zuren in zuur-base titraties en aardolieraffinage. Een andere belangrijke toepassing is het extraheren van metalen uit hun ertsen waar alkalische fusie, zoals fusie met natronloog, vaak wordt toegepast om de ertsen te openen. Bovendien wordt natriumhydroxide gebruikt om metalen als hydroxiden neer te slaan. Andere toepassingen zijn het terugwinnen van rubber, het oplossen van caseïne in de productie van kunststoffen, het raffineren van plantaardige oliën, het verwerken van textiel, als eluant in ionchromatografie, etsen en galvaniseren en als laboratoriumreagens. Natriumhydroxide wordt ook gebruikt als een sterke base in vele organische synthese en base-gekatalyseerde reacties.
gebruik
NaOH-oplossingen worden gebruikt om zuren te neutraliseren en natriumzouten te maken, bijvoorbeeld bij aardolieraffinage om zwavelzuur en organische zuren te verwijderen; om cellulose te behandelen bij het maken van viscoserayon en cellofaan; bij het terugwinnen van rubber om het weefsel op te lossen; bij het maken van kunststoffen om caseïne op te lossen. NaOH verdunningen hydrolyseren vetten en vormen zepen; zij precipiteren alkaloïden (basissen) en de meeste metalen (hoe hydroxiden) van de waterige verdunningen van hun zouten. Farmaceutische hulp (alkalizer).
preparaat
natriumhydroxide wordt samen met chloor vervaardigd door elektrolyse van een natriumchlorideoplossing. Verschillende soorten elektrolytische cellen worden commercieel gebruikt. Zij omvatten de kwikcel, de membraan cel, en de membraancel.een verzadigde oplossing van pekel wordt elektrolyzeerd. Chloorgas komt vrij aan de anode en natriumion aan de kathode. Ontleding van water produceert waterstof-en hydroxide-ionen. Het hydroxide-ion combineert met natriumionvormende NaOH. De totale elektrolytische reacties kunnen worden weergegeven als:
2Na+ + 2Cl – + 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
De kwikcel verloopt in twee fasen die afzonderlijk in twee cellen voorkomen. De eerste is bekend als de pekelcel of de primaire elektrolyzer waarin natriumion afzettingen op de kwikkathode amalgaam vormen, terwijl chloorgas vrijkomt bij de anode:
Na + + Cl – → na-Hg (kathode) + ½Cl2(g) (anode)
in de tweede cel, bekend als de decomposeercel, wordt een grafietkathode gebruikt, terwijl natriumamalgaam als anode dient. Water reageert met het natriummetaal van het amalgaam in de decomposer:
Na-Hg + H2o → Na+ + OH– + ½H2 + Hg
In chlooralkali-membraancellen wordt een diafragma gebruikt om chloor dat vrijkomt bij de anode te scheiden van het natriumhydroxide en waterstof dat wordt gegenereerd bij de kathode. Zonder diafragma, zal het gevormde natriumhydroxide met chloor combineren om natriumhypochloriet en chloraat te vormen. In veel cellen worden asbestmembranen gebruikt voor een dergelijke scheiding. Er zijn vele soorten membraancellen beschikbaar.
natriumhydroxide wordt geproduceerd als een watervrije vaste stof of als een 50% – oplossing in water.
definitie
de belangrijkste commercialcaustic.
productiemethoden
natriumhydroxide wordt vervaardigd door elektrolyse van pekel met behulp van inerte elektroden. Chloor wordt geëvolueerd als een gas bij de anode enhydrogeen wordt geëvolueerd als een gas bij de kathode. De verwijdering van chloride-en waterstofionen laat natrium-en hydroxideionen in oplossing achter.De oplossing wordt gedroogd om het vaste natriumhydroxide te produceren.
Een tweede methode gebruikt de cel Kellner–Solvay. De verzadigde oplossing van sodiumchloride wordt elektrolyseerd tussen een koolstofanode en een kwikkathode. In dit geval wordt het natrium in de kathode geproduceerd in plaats van in de waterstof, omdat sodium gereed is om op te lossen in het kwik. Het natrium-kwikamalgaam wordt dan blootgesteld aan water en er wordt een natriumhydroxideoplossing geproduceerd.
reacties
natriumhydroxide is sterk alkalisch en kan met zuren reageren om zouten en water te vormen.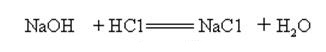
natriumhydroxide reageert met zure oxiden om zout en water te vormen, zodat natriumhydroxide kan worden gebruikt om zure gassen in het laboratorium of Industrieel te absorberen.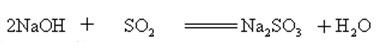
natriumhydroxide kan reageren met waterige oplossingen van vele metaalzouten tot natriumzouten en metaalhydroxiden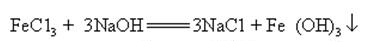
wanneer natriumhydroxide en ammoniakzout samen worden verhit, kan het ammoniak afgeven 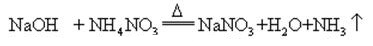
natriumhydroxide is zeer corrosief, zodat de glazen flessen waarin natriumhydroxideoplossingen worden opgeslagen, rubberen stoppen en glazen stoppen mogen niet worden gebruikt om te voorkomen dat een chemische reactie opent. Natriumhydroxide is een belangrijke industriële grondstof, en kan worden geproduceerd door elektrolyse van zoutoplossing industrieel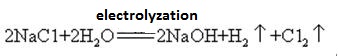
algemene beschrijving
een witte vaste stof. Corrosief voor metalen en weefsel. Gebruikt in chemische productie, aardolieraffinage, reinigingssamenstellingen, afvoerreinigers.
lucht & Waterreacties
oplosbaar in water. Ontbinding kan voldoende warmte vrij te maken stomen en spatten veroorzaken en ontsteken aangrenzende brandbaar materiaal .
Reactiviteitsprofiel
bijtende SODA (natriumhydroxide) is een sterke base. Reageert snel en exotherm met organische en anorganische zuren. Absorbeert gemakkelijk vocht uit de lucht om bijtende semi-vaste stoffen te geven die aluminium en zink aanvallen met de evolutie van brandbaar waterstofgas. Katalyseert de polymerisatie van aceetaldehyde en andere polymeriseerbare samenstellingen; deze reacties kunnen heftig voorkomen, bijvoorbeeld, acroleïne polymerizes met extreem geweld wanneer in contact gebracht met alkalische materialen zoals natriumhydroxide . Reageert met veel geweld met fosforpentaoxide wanneer het wordt geïnitieerd door lokale verwarming . Contact (als droogmiddel) met tetrahydrofuraan, die vaak peroxiden bevat, kan gevaarlijk zijn—explosies hebben plaatsgevonden bij een dergelijk gebruik van de chemisch vergelijkbare kaliumhydroxide . Door vermenging met een van de volgende stoffen in een gesloten recipiënt namen de temperatuur en de druk toe: ijsazijn, azijnzuuranhydride, acroleïne, chloorhydrine, chloorsulfonzuur, ethyleencyanohydrine, glyoxal, zoutzuur (36%), fluorwaterstofzuur (48,7%), salpeterzuur (70%), oleum, propiolacton, zwavelzuur (96%) . Accidenteel contact tussen een bijtende reinigingsoplossing (waarschijnlijk met natriumhydroxide) en Pentol veroorzaakte een heftige explosie. . Verhitting met een mengsel van methylalcohol en trichloorbenzeen tijdens een poging tot synthese leidde tot een plotselinge toename van de druk en een explosie . Hete en / of geconcentreerde NaOH kan ervoor zorgen dat hydrochinon exotherm ontbindt bij verhoogde temperatuur. (NFPA Pub. 491M, 1975, 385)
gevaar
Corrosief voor weefsel in aanwezigheid van vocht, sterk irriterend voor Weefsel (ogen, huid, slijmvliezen en bovenste luchtwegen), gif door spijsvertering.
gezondheidsrisico
sterke corrosieve werking op contactweefsels. Inademing: stof kan schade aan de bovenste luchtwegen en de longen zelf veroorzaken, veroorzaakt door lichte neusirritatie tot pneumonitis. Inslikken: ernstige schade aan de slijmvliezen; ernstige littekenvorming of perforatie kan optreden. Oogcontact: Veroorzaakt ernstige schade.
gezondheidsrisico
natriumhydroxide is een sterk corrosieve stof die schade aan menselijke weefsels veroorzaakt.De werking op de huid verschilt enigszins van zure brandwonden. Er is geen onmiddellijke pijn, maar het dringt door de huid. Het coagulateproteïne niet om zijn verdere penetratie te voorkomen, en dus kan de bijtende brandwond ernstig worden en langzame genezing. Morsen van zijn concentratedsolutions in de ogen kan resulteren in severeirritation of permanent letsel.het is zowel door inslikken als door inademing van het stof giftig. Hoewel de orale toxiciteit van een 5-10% – oplossing van natronloog bij proefdieren laag bleek te zijn, kunnen hoge doseringen bij grotere concentraties braken,prostratie en instorting veroorzaken. De orale letale dosein konijnen is 500 mg / kg (NIOSH 1986).Natriumhydroxidestof of aërosolen worden aan de ogen, neus en keel blootgesteld. Verlengde blootstelling aan hoge concentraties in de lucht kan ulceratie van de neusholte veroorzaken.
brandgevaar
onbrandbaar, de stof zelf verbrandt niet, maar kan bij verhitting ontleden om corrosieve en/of giftige dampen te produceren. Sommige zijn oxidatiemiddelen en kunnen brandbare stoffen (hout, papier, olie, kleding, enz.). Contact met metalen kan ontvlambaar waterstofgas ontwikkelen. Containers kunnen exploderen bij verhitting.
ontvlambaarheid en Ontplofbaarheid
natriumhydroxide en kaliumhydroxide zijn niet ontvlambaar als vaste stof of als wateroplossingen.
farmaceutische toepassingen
natriumhydroxide wordt veel gebruikt in farmaceutische formuleringen om de pH van oplossingen aan te passen. Het kan ook worden gebruikt om met weakaciden te reageren om zouten te vormen.
industrieel gebruik
natronloog (NaOH) wordt beschouwd als de sterkste alkalische pH-regulator. Bijtende sodais een zeer actieve stof en is zeer corrosief. Het grootste deel van natronloog wordt geproduceerd door elektrolyse van verzadigde zouten (NaCl). Bijtende soda heeft een zeer sterke phregulerende capaciteit (d.w.z. van pH 7 tot pH 14) bij een relatief lage dosering in vergelijking met andere alkalische stoffen. Commercieel is bijtende soda beschikbaar in watervrije vorm, maar in de meeste mijnbouwtoepassingen wordt de bijtende soda geleverd als een 50% – oplossing.
in de minerale verwerkende industrie wordt natriumhydroxide meestal gebruikt voor de beheersing van de alkaliniteit bij de verwerking van niet-metaalhoudende mineralen. Bij flotatie van onedel metaal is het gebruik van natriumhydroxide zeldzaam.
veiligheidsprofiel
Gif via intraperitoneale route. Matig giftig bij inname. Mutatiegegevens gerapporteerd. Een corrosief irriterend voor huid, ogen en slijmvliezen. Bij verhitting om te ontbinden stoot het giftige dampen van NanO uit.
veiligheid
natriumhydroxide wordt veel gebruikt in de farmaceutische en voedingsindustrie en wordt over het algemeen beschouwd als een niet-toxisch materiaal bij lage concentraties. Bij hoge concentraties is het een corrosief irriterend voor de huid, ogen en slijmvliezen.
LD50 (muis, IP): 0,04 g / kg
LD50 (konijn, oraal): 0,5 g / kg
potentiële blootstelling
NaOH wordt gebruikt voor het neutraliseren van zuren en het maken van natriumzouten bij aardolieraffinage, viscoserayon; cellofaan, kunststofproductie; en in de terugwinning van oplossingen van hun zouten. Het wordt gebruikt bij de vervaardiging van gemerceriseerd katoen, papier, explosieven en kleurstoffen in metaalreiniging; elektrolytische extractie van zink; tinplating; oxide coating; witwassen, bleken, afwasmiddel; en het wordt gebruikt in de chemische industrie.
opslag
spatbeenbeschermers en ondoordringbare handschoenen dienen te allen tijde te worden gedragen bij het hanteren van deze stoffen om contact met de ogen en de huid te voorkomen. Handelingen met metaalhydroxidesoluties die aerosolen kunnen veroorzaken, moeten in een fumehood worden uitgevoerd om blootstelling door inademing te voorkomen. NaOH en KOH genereren aanzienlijke warmte wanneer opgelost in water; bij het mengen met water, voeg altijd bijtende stoffen langzaam aan het water en roer continu. Voeg nooit in beperkte hoeveelheden water toe aan solidhydroxiden. Containers met hydroxiden moeten worden opgeslagen op een koele, droge plaats, gescheiden van zuren en onverenigbare stoffen.
opslag
natriumhydroxide moet worden bewaard in een luchtdichte niet-metalen container op een koele, droge plaats. Bij blootstelling aan lucht absorbeert sodiumhydroxide snel vocht en wordt het vloeibaar, maar wordt vervolgens weer vast als gevolg van de absorptie van kooldioxide en de vorming van natriumcarbonaat.
verzending
UN1823 NaOH, vast, gevarenklasse: 8; etiketten: 8-corrosief materiaal. UN1824 NaOH, oplossing, gevarenklasse: 8; etiketten: 8-corrosief materiaal
zuiveringsmethoden
veel voorkomende verontreinigingen zijn water en natriumcarbonaat. Natriumhydroxide kan worden gezuiverd door 100g in 1L zuivere EtOH op te lossen, waarbij de oplossing onder vacuüm door een fijne gesinterde glazen schijf wordt gefilterd om onoplosbare carbonaten en halogeniden te verwijderen. (Deze en volgende handelingen moeten worden uitgevoerd in een droge, CO2-vrije doos.) De oplossing wordt onder vacuüm geconcentreerd, door middel van milde verhitting, om een dikke mengmest van het mono-alcoholaat te geven die wordt overgebracht naar een grove gesinterde glazen schijf en vrij van moedervloeistof wordt geëvacueerd. Na het wassen van de kristallen meerdere malen met gezuiverde alcohol om sporen van water te verwijderen, worden ze gedroogd in een vacuüm, met milde verwarming, voor ongeveer 30 uur om het alcoholaat te ontbinden, waardoor een fijn wit kristallijn poeder . BIJTEND. Natriumhydroxideoplossingen (bijtend), 14.77. Carbonaat ion kan worden verwijderd door passage door een anion-uitwisseling kolom (zoals Amberlite IRA-400; Oh–vorm). De kolom moet vers worden bereid uit de chloridevorm door langzame voorafgaande passage van natriumhydroxideoplossing totdat het effluent geen test op chloride-ionen oplevert. Na gebruik kan de kolom worden geregenereerd door te wassen met verdund HCl, vervolgens water. Ook andere metaalionen worden verwijderd wanneer een 1m (of meer verdunde) NaOH-oplossing door een kolom van Dowex-ion-exchange a-1-hars in de Na+ – vorm wordt geleid. Als alternatief kan de carbonaatverontreiniging worden verminderd door NaOH (analytische reagenskwaliteit) snel met H2O te spoelen en vervolgens op te lossen in gedestilleerd H2O, of door een geconcentreerde waterige oplossing van NaOH te bereiden en de heldere supernatans af te zuigen. (Onoplosbaar Na2CO3 blijft achter.) Carbonaatverontreiniging kan worden verminderd door een lichte overmaat van geconcentreerd BaCl2 of Ba(OH)2 aan een NaOH-oplossing toe te voegen, goed te schudden en het baco3-precipitaat te laten bezinken. Als de aanwezigheid van Ba in de oplossing onaanvaardbaar is, kan een elektrolytische zuivering worden gebruikt. Bijvoorbeeld, natrium amalgaam wordt bereid door de elektrolyse van 3L van 30% NaOH met 500mL zuiver kwik voor kathode, en een platina anode, passeren 15 Faradays op 4Amps, in een dikwandige polyethyleen fles. De fles wordt vervolgens voorzien van inlaat-en uitlaatbuizen, waarbij de gebruikte oplossing door CO2-vrij N2 wordt weggespoeld. Het amalgaam wordt vervolgens grondig gewassen met een groot volume gedeïoniseerd water (met de elektrolyse stroom ingeschakeld om verlies van Na te minimaliseren). Ten slotte wordt een schone stalen staaf in de oplossing in contact gebracht met het amalgaam (om de waterstofontwikkeling te vergemakkelijken), waarbij de reactie wordt toegestaan totdat een geschikte concentratie is bereikt, alvorens naar een opslagvat te worden overgebracht en naar behoefte te worden verdund . onverenigbaarheden een sterke base en een sterke oxidator. Gewelddadige reactie met zuur. Onverenigbaar met water; ontvlambare vloeistoffen; organische halogenen, nitromethaan, en nitrocomponenten, brandbare stoffen. Absorbeert snel kooldioxide en water uit de lucht. Contact met vocht of water kan warmte genereren. Corrosief voor metalen. Contact met zink, aluminium, tin en lood in aanwezigheid van vocht, de vorming van explosieve waterstofgas. Aanvallen sommige vormen van kunststoffen, rubber of coatings.
onverenigbaarheden
natriumhydroxide is een sterke base en is onverenigbaar met elk bestanddeel dat gemakkelijk hydrolyse of oxidatie ondergaat. Het reageert met zuren, esters en ethers, vooral in waterige oplossing.
afvalverwijdering
lozen in tank met water, neutraliseren en vervolgens met water in het riool spoelen.
wettelijke Status
GRAS vermeld. Goedgekeurd voor gebruik als levensmiddelenadditief in Europa.Opgenomen in de FDA inactieve ingrediënten Database (dentalpreparaties; injecties; inhalaties; nasale, oftalmische, orale, otic,rectale, topische en vaginale preparaten). Opgenomen in niet-parenterale en parenterale geneesmiddelen die in het Verenigd Koninkrijk zijn toegelaten. Opgenomen in de canadische lijst van aanvaardbare niet-medicinale ingrediënten.
Leave a Reply