Koolstof: de essentials
koolstof is een element van groep 14 en is zeer wijd verspreid in de natuur. Het wordt in overvloed gevonden in de zon, sterren, kometen en atmosferen van de meeste planeten. Koolstof is aanwezig als kooldioxide in de atmosfeer en opgelost in alle natuurlijke wateren. Het is een component van rotsen als carbonaten van calcium( kalksteen), magnesium, en ijzer. De atmosfeer van Mars is erg dun, maar wat er is bevat ongeveer 95% CO2.
steenkool, aardolie en aardgas zijn voornamelijk koolwaterstoffen. Koolstof is uniek onder de elementen in het enorme aantal verschillende verbindingen die het kan vormen. Organische chemie, een 1 / 112e deelverzameling van anorganische chemie, is de studie van koolstof en zijn verbindingen. Hoewel silicium de plaats van koolstof zou kunnen innemen bij het vormen van een groot aantal verwante verbindingen, is het momenteel niet mogelijk om stabiele verbindingen te vormen met zeer lange ketens van siliciumatomen.
koolstof wordt vrij gevonden in de natuur in drie allotrope vormen: amorf, grafiet en diamant. Grafiet is een van de zachtste bekende materialen, terwijl diamant een van de hardste is. Koolstof, als microscopische diamanten, wordt gevonden in sommige meteorieten. Natuurlijke diamanten worden gevonden in oude vulkanische “pijpen”, zoals gevonden in Zuid-Afrika. Diamanten worden ook teruggevonden op de oceaanbodem bij Kaap de Goede Hoop.

een diamanten ring.
recenter werd een andere vorm van koolstof, buckminsterfullereen, C60, ontdekt. Deze vorm van koolstof is het onderwerp van grote belangstelling in onderzoekslaboratoria vandaag.
zuivere koolstof is beschikbaar in een aantal verschillende vormen (allotropen). De meest voorkomende vorm van zuivere koolstof is α-grafiet. Dit is ook de thermodynamisch meest stabiele vorm. Diamant is een tweede vorm van koolstof, maar komt veel minder vaak voor. Andere vormen van koolstof zijn de fullerenen. Terwijl diamant en grafiet oneindige roosters zijn, is fullerenen zoals buckminsterfullereen, C60, een discrete moleculaire soort. Amorfe vormen van koolstof zoals roet en lampzwart zijn materialen die bestaan uit zeer kleine deeltjes grafiet.
het meeste grafiet is α-grafiet en het heeft een laagstructuur waarin elke koolstof direct gebonden is aan drie andere koolstofatomen op een afstand van 141,5 pm. Delokalisatie in de binding is duidelijk omdat de C-C afstanden gelijk en korter zijn dan normale koolstof-koolstof enkelvoudige bindingen (typcaal 154 pm). De afstand tussen de lagen koolstofatomen is 335,4 pm. In de meeste grafiet (α-grafiet) zijn de lagen van atomen gerangschikt in een ABABAB… herhaal mode maar de β-vorm (rhombohedral) het stapelen is ABCABCABC… hoewel de afstand tussen koolstof en koolstof en de afstand tussen de lagen hetzelfde blijven als in de α-vorm. Het enthalpieverschil tussen α-En α-grafiet is minder dan 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1). Vormen van de zwaardere elementen die overeenkomen met grafiet zijn niet bekend en de structuren van silicium, germanium en grijs tin zijn gerelateerd aan de diamantstructuur (hieronder).

Atom arrangements in the most common allotrops of carbon: α-graphite.
omdat diamant een iets compactere structuur heeft, is de dichtheid groter dan die van grafiet. Het uiterlijk van diamant is bekend en het is ook een van de hardste materialen bekend. Net als grafiet is het relatief onwerkzaam, maar brandt het wel in de lucht bij 600-800°C. Elk koolstofatoom is gebonden aan vier buren op een afstand van 154.45 pm in een tetraëder manier en dus elk diamant kristal is een enkele gigantische rooster structuur. In principe (en in de praktijk!) grafiet kan worden omgezet in diamant door toepassing van warmte en druk. De eenheidscel van diamant is kubisch met A = 356,68 pm. Bijna alle diamanten bezitten deze structuur, maar een zeer klein percentage vertoont een zeshoekige structuur gerelateerd aan wurtziet en deze worden lonsdaleiet genoemd.

kristalstructuren van diamant.
onlangs werd een andere allotrope van koolstof gekarakteriseerd. Terwijl diamant en grafiet oneindige roosters zijn, is buckminsterfullereen, C60, een discrete moleculaire soort. Het buckminsterfullereenmolecuul is een net van 12 vijfhoeken en 20 zeshoeken gevouwen in een bol. Het effect is zeer vergelijkbaar met de lappendeken van 12 vijfhoekige en 20 zeshoekige stukken leer die aan elkaar genaaid vormen een vereniging voetbal (voetbal). De naam buckminsterfullerene (of buckyball) werd bedacht vanwege de relatie tussen de structuur van de C60 en R. Buckminster Fuller ‘ s geodetische koepel ontwerpen. Buckminsterfullereen is nu in de handel verkrijgbaar en is ook geïdentificeerd in de interstellaire ruimte en roet.
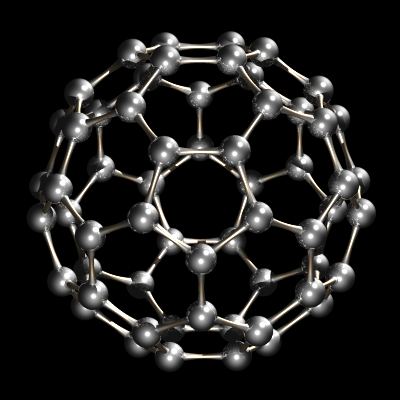
C60, Buckminsterfullereen.
andere fullerenen (gesloten koolstofkooien) zoals C60 en C84 zijn ook bekend en inded commercieel verkrijgbaar. Het kleinst mogelijke fullereen is de dodecahedral C20, bestaande uit 12 vijfhoeken en helemaal geen zeshoeken. Nanobuizen zijn verwant aan fullerenen. Het zijn buizen die het uiterlijk van gewalst grafiet geven, hoewel ze van grafiet zijn gemaakt. Ze zijn open ended terwijl fullerenen gesloten structuren zijn.
een interessant kenmerk van fullerenen is hun vermogen om atomen zoals kalium en andere alkalimetalen te omsluiten om endohedrale structuren te maken die aangeduid worden als [email protected] 1961 nam de International Union of Pure and Applied Chemistry (IUPAC) de isotoop 12C over als basis voor atoomgewichten. Koolstof-14, 14C, een isotoop met een halveringstijd van 5730 jaar, wordt gebruikt om materialen zoals hout, archeologische specimens, enz.te dateren. Koolstof-13, 13C, is bijzonder nuttig voor isotopenetiketteringsstudies omdat het niet radioactief is, maar een spin i = 1/2 kern is en dus een goede NMR kern.
Leave a Reply