covalente verbindingen
u hebt nu een kort idee waarom verschillende elementen zich anders gedragen. Maar weet je een groot deel van het is vanwege de” aard ” van de bindingen in de verbindingen. Net als u en uw beste vrienden hebben een aantal verschillen als gevolg van de” innerlijke ” kwaliteiten, zo is het geval met Ionische en covalente verbindingen. In dit hoofdstuk zullen we meer leren over het concept van covalente verbindingen, kijken naar hun eigenschappen en meer.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Dit komt omdat de atomen binnen de covalente molecules zeer strak bij elkaar worden gehouden. Elk molecuul is inderdaad vrij afzonderlijk en de aantrekkingskracht tussen de individuele moleculen in een covalente verbinding neigt zwak te zijn.
we hebben weinig energie nodig om de moleculen te scheiden. Dit is vanwege de aantrekkelijke krachten tussen de moleculen met de afwezigheid van algemene elektrische lading. Covalente verbindingen zijn meestal gasmoleculen bij kamertemperatuur en druk. Het kunnen ook vloeistoffen zijn met lage relatief lage kookpunten.
deze eigenschappen kunnen worden toegeschreven aan hun zwakke intermoleculaire krachten die deze atomen bij elkaar houden. We hebben echter ook veel vaste covalente verbindingen. Ze hebben lage smeltpunten. Het is echter interessant op te merken dat een klein aantal van deze hebben een geheel andere structuur. Ze vormen enorme structuren waar een groot aantal atomen bij elkaar worden gehouden. Dit is mogelijk door de aanwezigheid van gedeelde elektronen.
deze gigantische moleculaire structuren zijn in principe roosters die bestaan uit moleculen die door een covalente bindingen-structuur bij elkaar worden gehouden. Deze covalente bindingen zijn erg sterk. Zij neigen ook om zeer hard met hoge smeltpunten te zijn die van de meeste covalente samenstellingen verschillend zijn. Het voorbeeld van dit soort covalente verbindingen omvat diamant en grafiet van koolstofatoom netwerk. Zij omvatten ook silica van silicium en zuurstofatomen netwerk.
Download de Chemische Binding Cheat Sheet in PDF door te klikken op de knop Download hieronder


Blader meer Onderwerpen onder de Chemische Binding En de Moleculaire Structuur
- Bond Parameters
- Grondslagen van de Chemische Binding
- Hybridisatie
- Waterstof Binding
- Ionische of Electrovalent Verbindingen
- Moleculaire Orbitaal Theorie
- Polariteit van Bindingen
- Resonantie Structuren
- Valence Bond Theorie
- VSEPR theorie
Algemene Eigenschappen van covalente verbindingen
- covalente verbindingen hebben meestal lage smeltpunten. Een uitzondering hierop zijn moleculen van silica en diamanten die een hoog smeltpunt hebben.
- deze verbindingen hebben een laag kookpunt. Dit kan worden toegeschreven aan hun zwakke aantrekkingskracht tussen de verschillende gebonden atomen. Van der Waals krachten binden deze atomen.
- deze verbindingen zijn meestal gassen en vloeistoffen met een laag kook-en smeltpunt.
- de vaste covalente verbindingen hebben zachte structuren zoals grafiet. Dit komt door de aanwezigheid van een wolk van elektronen tussen elke laag koolstofatomen.
- deze verbindingen zijn niet-geleiders van elektrische lading. Het ontbreken van geladen ionen is de belangrijkste reden hiervoor. Een uitzondering hierop is grafiet, waar we een wolk elektronen zien. Deze maken grafiet een goede geleider.
- zij zijn ook slechte warmtegeleiders. Hun moleculen missen vrije elektronen en dat belemmert de stroom van warmte-energie.
- covalente verbindingen hebben geen polaire eigenschappen als algemene eigenschap. Daarom zijn deze verbindingen onoplosbaar in water. Watermoleculen zijn niet absoluut neutraal en hebben een lichte negatieve lading op het zuurstofatoom en lichte positieve ladingen op de waterstofatomen en aangezien covalente verbindingen zijn samengesteld uit neutrale moleculen of moleculen met lichte ladingen en dus niet sterk aangetrokken tot watermoleculen.
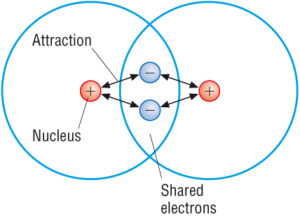
(bron:: Google)
fysische en chemische eigenschappen
- De vloeibare covalente verbindingen verdampen. Dit betekent dat de moleculen van vloeistoffen en vaste stoffen van hun oppervlak in de lucht verliezen.
- deze verbindingen hebben veel minder affiniteit tussen hun moleculen.verschillende covalente verbindingen hebben hun eigen karakteristiek gevormde moleculen. Hun bindingen zijn gericht op vooraf ingestelde hoeken.
- sommige verbindingen, met name geneesmiddelen, zijn oplosbaar in water. De rest is oplosbaar in olie.
- de meeste covalente verbindingen zijn apolair of hebben zeer weinig neiging om volledig te splitsen om ionen te vormen en dus nooit elektriciteit te geleiden.
- bij normale temperatuur en druk vinden we deze verbindingen als vloeistoffen of gassen. Maar er zijn ook vaste stoffen en ze hebben een hoger molecuulgewicht.
- de covalente verbindingen kristallen zijn van twee typen: een met een zwakke Van der Waal kracht die deze samen houdt zoals in jodium. Deze zijn gemakkelijk smeltbaar en Vluchtig ander die een groot netwerk van atomen hebben die macromoleculen opzetten.
- deze verbindingen zijn oplosbaar in organische oplosmiddelen zoals ether en benzeen.
- covalente bindingen zijn directioneel van aard. Daarom vertonen ze het fenomeen isomerisme.
- covalente verbindingen hebben een zeer lage reactiesnelheid, in tegenstelling tot de verschillende ionverbindingen.
opgeloste voorbeelden voor u
vraag: Waarom zijn covalente verbindingen niet oplosbaar in water?
antwoord: watermoleculen zijn niet absoluut neutraal. Deze moleculen hebben een lichte negatieve lading op het zuurstofatoom en lichte positieve ladingen op de waterstofatomen. Aan de andere kant weten we dat de covalente verbindingen bestaan uit neutrale moleculen of moleculen met lichte ladingen. Het is om deze reden dat deze verbindingen niet sterk aangetrokken tot watermoleculen.
Leave a Reply