CIMAvax-EGF: EEN roman therapeutisch vaccin voor gevorderde longkanker
RAPPORT
CIMAvax-EGF: EEN roman therapeutisch vaccin voor gevorderde longkanker
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia Neninger2
1Center van Moleculaire Immunologie, CIMAve. 216 corner 15, Atabey, Playa, POBox 16 040, Havana, Cuba 2Hermanos Ameijeiras HospitalSan Lázaro # 701 e / Belascoín y Marqués González, Centro Habana, Havana City, Cuba.
ABSTRACT
de resultaten op grond waarvan het Cubaanse regelgevende agentschap (CECMED) de sanitaire registratie van het CIMAVAX-EGF cancer vaccine for advanced non-small cell long cancer (NSCLC) kan verlenen, worden getoond. Dit was de eerste registratie van een therapeutisch vaccin in Cuba en ook de eerste registratie van een longkankervaccin in de wereld. Daarom wordt een uniek therapeutisch vaccin aangeboden aan longkankerpatiënten, dat de overleving en de kwaliteit van leven zal verhogen. Hiervoor moesten belangrijke preklinische, klinische, regelgevende, productieve en onderhandelingsuitdagingen worden aangepakt. De resultaten op deze gebieden leidden tot 18 wetenschappelijke papers gepubliceerd in high impact tijdschriften en 4 invention objects, het genereren van verschillende patenten in Cuba en andere landen. In de preklinische setting werden immunogeniciteit, veiligheid en antitumorale effecten bij verschillende diersoorten aangetoond. De klinische ervaring begon in 1995. Tot nu toe zijn vijf fase I-II klinische proeven afgerond in Cuba, twee fase II zijn ook afgerond, een in Cuba en een andere in Canada en het Verenigd Koninkrijk, en een Fase II-III studie met een geoptimaliseerd schema evenals een fase III studie zijn momenteel aan de gang in Cuba. Op regelgevingsgebied werd een snelle registratiestrategie ontwikkeld en uitgevoerd. Er waren nieuwe regelgevingsconcepties nodig om dit unieke product te ontwikkelen. Een schaalbaar, reproduceerbaar en gecontroleerd productieproces werd uitgevoerd, samen met een kwaliteitssysteem dat volledige GMP-naleving garandeerde. De middelen voor productontwikkeling kwamen voort uit het implementeren van een nieuwe onderhandelingsstrategie: onderhandelen over immateriële activa.
trefwoorden: Cancer vaccine, NSCLC, Fast-Track Registration, CIMAvax-EGF, Fase II-III klinische studie
introductie
de relatie tussen het systeem gevormd door de epidermale groeifactor receptor (EGFR) en zijn liganden met kankerontwikkeling is bekend. In epidermoid oorsprong tumoren, is er een overexpressie van de EGFR die betrekking heeft op slechte prognoses en vroege terugvallen na de operatie. Dat is de reden waarom dit systeem is uitgegroeid tot een belangrijk doel voor anti-tumor therapieën.
mechanismen voor celproliferatie worden gestart met de binding van EGF aan EGFR. Onze therapeutische aanpak bestaat uit een vaccin met een EGF-formulering die het immunogeen maakt en een humorale immuunrespons induceert. De productie van specifieke anti-EGF-antilichamen die binden aan het autologe EGF, voorkomt dat het aan de EGFR bindt, waardoor de uit die interactie afgeleide celproliferatiemechanismen worden geactiveerd (1-4).
hier rapporteren we de resultaten van de registratie in Cuba van dit vaccin (CIMAVAX-EGF). Dit maakte deel uit van een wereldwijde strategie met nieuwe klinische, regelgevende, en technologische en zakelijke bijdragen, en wordt ondersteund door 18 internationale wetenschappelijke papers en intellectuele eigendom wereldwijd. We beschrijven ook innovaties op verschillende gebieden die de registratie van CIMAVAX-EGF in Cuba en Peru mogelijk maakten.
resultaten en discussie
vaccinatie met EGF is veilig, immunogeen en verhoogt de overleving met een goede kwaliteit van leven bij patiënten in een gevorderd stadium longkanker
de klinische ervaring met CIMAVAX-EGF in de geneesmiddelen voor niet-kleincellig longkanker (NSCLC) in een gevorderd stadium begon in 1995. Tot nu toe zijn vijf fase I-II klinische proeven in Cuba afgerond; twee gerandomiseerde fase II klinische proeven werden afgerond, een in Cuba en een andere in Canada en het Verenigd Koninkrijk, en er is een fase III studie aan de gang in Cuba. Meer dan 800 kankerpatiënten in een gevorderd stadium zijn behandeld met CIMAvax–EGF, waaruit blijkt dat CIMAvax veilig, immunogeen en in staat is de overleving met een goede kwaliteit van leven te verhogen.
Het hoofddoel van de fase I-II-onderzoeken was het bepalen van de beste vaccinformulering (dragereiwit en adjuvans), de dosis en het therapeutische schema. Deze resultaten toonden de voordelen aan van het p64k-eiwit als dragereiwit en Montanide Isa51 als adjuvans. De verhoogde immunogeniciteit van het verhogen van de dosis werd ook aangetoond (5-7).
de analyse van de gepoolde gegevens van alle Fase I-II-onderzoeken toonde een significante toename van de overleving aan bij patiënten met een betere antilichaamrespons of een goede antilichaamrespons (GAR), en bij patiënten met een meer uitgesproken daling van de sera EGF-concentraties () als gevolg van vaccinatie. Een significante toename van de overleving van alle gevaccineerde patiënten werd ook aangetoond in vergelijking met een gelijktijdige historische controle (7).
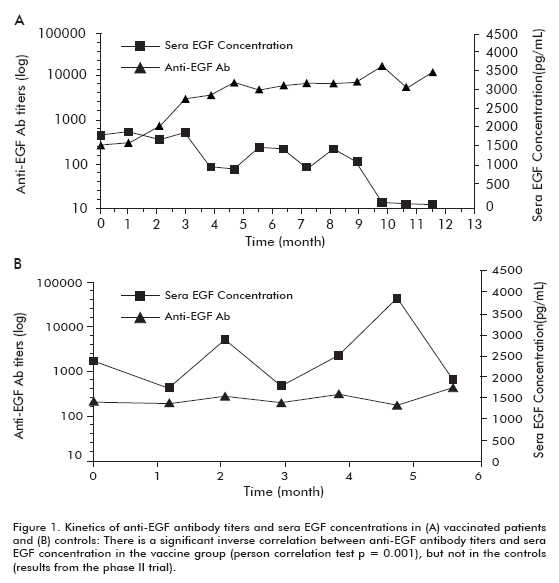
een Fase II klinisch onderzoek werd uitgevoerd bij 80 patiënten, die gerandomiseerd waren naar cimavax-EGF en de best supportive care (BSC) (40 patiënten) of alleen BSC (40 patiënten), na het beëindigen van eerstelijns chemotherapie. De vorige bevindingen werden in dit onderzoek bevestigd. Ongeveer 50% van de gevaccineerde patiënten was GAR en overleefde significant meer dan patiënten die de gar-classificatie niet bereikten (die werden geclassificeerd als arme antilichaamresponders, PAR). Evenzo overleefden patiënten met de grootste afname significant meer dan patiënten die deze afname niet vertoonden (Tabel 1). Er werd een significante omgekeerde correlatie waargenomen tussen anti-EGF antilichaamtiters en , die optrad bij gevaccineerde patiënten, maar niet in de controlegroep, wat aantoont dat deze door vaccinatie werd veroorzaakt (figuur 1).
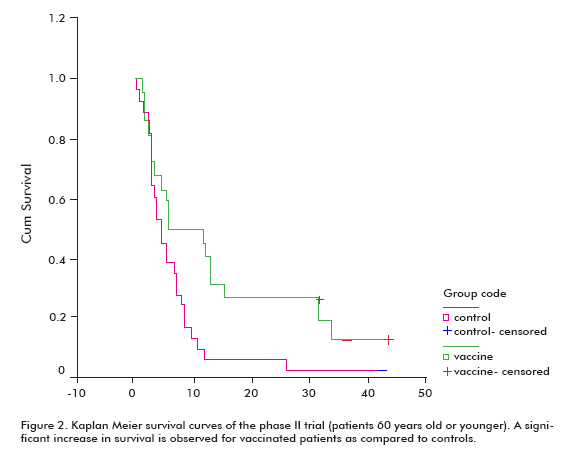
Er was een verhoogde trend in overleving bij alle gevaccineerde patiënten (18,53 ± 11,47; gemiddelde ± mediaan), vergeleken met de niet-gevaccineerde controles (7,55 ± 5.33), wat significant was in de groep patiënten die 60 jaar of jonger waren (Log rank test; p < 0,05) (Figuur 2) (8).
zoals blijkt uit een in vitro competition assay, remde sera van gevaccineerde patiënten de binding van EGF aan EGFR. Deze remming van de binding was evenredig met antilichaamtiters en overleving. Bovendien remde sera van gevaccineerde patiënten de EGFR-fosforylering in verhouding tot de anti-EGF-antilichaamtiters.
de preferentiële erkenning van de EGF/EGFR-bindingsplaats (lus B van het EGF-molecuul) werd onderzocht. Patiënten met sera die lus B bij voorkeur herkennen, overleefden significant meer dan patiënten die deze epitoop niet herkennen (9).
een dosis/schema optimalisatie studie werd onlangs afgerond in Cuba (Fase I-II). Bij de opzet werden alle elementen die de immunogeniciteit in eerdere onderzoeken verhogen, in aanmerking genomen, waaronder: Montanide isa51 als adjuvans, verhoogde doses, vier injectieplaatsen en toediening van twee vaccindoses voorafgaand aan eerstelijns chemotherapie, gevolgd door vaccinatie. De resultaten van dit onderzoek toonden een significante toename van immunogeniciteit aan, waarbij 95% van GAR tien keer de vorige maximale antilichaamtiters bereikte. Alle gevaccineerde dieren overleefden significant meer dan de controlegroepen uit het Fase II-onderzoek (10).
een verhoogde capaciteit van de sera van patiënten om EGF / EGFR-binding en EGFR-fosforylering te remmen werd ook gevonden. Op maand zeven, na het afsluiten van chemotherapie, de antilichaamrespons verschoven naar lijn B van het EFG molecuul, die een verbetering van de kwaliteit van de immuunrespons zou kunnen wijzen. De resultaten van dit onderzoek toonden aan dat de respons op CIMAvax-EGF kan worden verbeterd door de dosis en het therapeutische schema te manipuleren (10).
de resultaten van deze onderzoeken worden gevalideerd in een fase III-onderzoek dat momenteel in Cuba wordt uitgevoerd.
ontwerp en uitvoering van een regelgevingsstrategie voor de registratie van vaccins om het beschikbaar te maken voor alle patiënten met gevorderde niet-kleincellige longkanker
CIMAvax-EGF is een therapeutisch vaccin voor longkanker dat uniek is in de wereld. Er werd een globale strategie ontworpen en uitgevoerd; deze werd geleid door wettelijke vereisten, voor snelle registratie in Cuba. Een nauwe relatie tussen de sponsor (CIM) en het Cubaanse regelgevende agentschap (CECMED) had tot doel de vereisten vast te stellen voor het verkrijgen van een product en de snelle toepassing ervan in het voordeel van gevorderde kankerpatiënten zonder enig ander therapeutisch alternatief. Deze strategie omvatte het ontwerp van een kwaliteitssysteem, kwaliteitscontroles en specificaties, evenals GMP-vereisten om de verschillende stappen van productontwikkeling te dekken. Deze globale strategie kan worden gebruikt bij de ontwikkeling van andere soortgelijke producten.
de geaccumuleerde regelgevingservaring en documentatie leidde tot de goedkeuring van klinische proeven in verschillende landen. Dankzij het dossier met alle informatie kon CIMAvax-EGF in Cuba en Peru Worden geregistreerd. We kunnen dus stellen dat we in verschillende landen een bepaalde strategie hebben voor de registratie van geneesmiddelen.
het GMP-productieproces dat een product genereert dat schaalbaar, consistent is en voldoet aan de specificaties
de eerste uitdaging om een productieproces voor CIMAVAX-EGF te ontwerpen was om een immunogeen EGF-preparaat te hebben. Het werd verkregen door de chemische conjugatie van het humane recombinant EGF aan het recombinante membraaneiwit P64k (van Neisseria meningitidis). Het conjugaat wordt geïnjecteerd samen met een geschikt adjuvans (momenteel Montanide Isa 51 Uit Seppic, Frankrijk).
een proces op laboratoriumschaal werd aanvankelijk ontworpen. Een opschaalbaar (en schaalbaar) sanitair en reproduceerbaar proces werd later ontworpen en geïmplementeerd, conform de GMP-richtlijnen. In vitro en in vivo analyses werden ook ontworpen en uitgevoerd om de kwaliteit van de grondstoffen en de tussen-en eindproducten te evalueren.
alle wijzigingen werden beoordeeld en ondersteund door de huidige Regelgevingsstrategie. De resultaten van de equivalentiestudie, om beide producten te vergelijken, kregen de goedkeuring van CECMED voor de toepassing van de schaalprocédé en de goedkeuring van het in dit proces verkregen product voor klinisch gebruik. Het opschalen en optimaliseren van het productieproces maakte plaats voor een publicatie (11) en een nieuw vindingobject, met patenten die vervolgens in verschillende landen werden gepresenteerd.
onderhandeling over immateriële activa verleende Amerikaanse fondsen voor projectontwikkeling en ook leerervaring in ons gezamenlijk werk met regelgevende instanties uit verschillende landen
Dit Project werd onderhandeld met buitenlandse tegenhangers op basis van het nieuwe concept van “onderhandeling over immateriële activa”, voornamelijk ondersteund door de intellectuele eigendom van ons product dat in ontwikkeling was. Deze onderhandelingsstrategie bestond uit het verlenen van vergunningen voor de gezamenlijke ontwikkeling van het project met andere landen, wat betekent dat de buitenlandse tegenhangers de kosten van regulerende maatregelen en klinische proeven op hun grondgebied betaalden. Als gevolg van deze onderhandelingen ontving Cuba betalingen voor mijlpalen. Deze manier van onderhandelen zorgde er ook voor dat we voortdurend konden uitwisselen met specialisten in binnen-en buitenland, waardoor onze ervaring werd vergroot. Onze positieve resultaten met deze onderhandelingsmodaliteit kunnen worden toegepast op andere producten in ons land.
relevantie van de studie
CIMAvax-EGF is het eerste therapeutische vaccin voor kankerbehandeling dat in Cuba is geregistreerd en het eerste ter wereld is geregistreerd voor de behandeling van longkanker. Longkanker is een onopgelost gezondheidsprobleem met meer dan 1,3 miljoen gevallen gediagnosticeerd per jaar en hetzelfde aantal sterfgevallen over de hele wereld. In Cuba is het de belangrijkste doodsoorzaak als gevolg van kanker bij beide geslachten met een incidentie van meer dan 4000 doden per jaar. De therapie van keuze voor patiënten gediagnosticeerd in gevorderde stadia is die van eerstelijns chemotherapie, die gelijktijdig met radiotherapie kan worden toegediend. Dit is een palliatieve, niet-curatieve behandeling, waarbij een volledige respons op chemotherapie zeer zeldzaam is en objectieve respons (volledig of gedeeltelijk) slechts bij 25% van de patiënten optreedt.
CIMAvax-EGF biedt een alternatieve behandeling voor deze patiënten die al eerstelijns chemotherapie hebben gekregen. De ernstige bijwerkingen van chemotherapie en / of radiotherapie zijn algemeen bekend en verslechteren de kwaliteit van leven ernstig. In plaats daarvan genereert vaccinatie met CIMAVAX-EGF slechts lichte of matige, in plaats van ernstige, bijwerkingen die kunnen worden opgelost met conventionele ondersteunende zorg, terwijl de overleving van gevorderde longkankerpatiënten wordt verbeterd en een goede kwaliteit van leven wordt geboden.
tot nu toe zijn meer dan 800 Cubanen in meer dan 20 ziekenhuizen in het hele land met CIMAVAX-EGF behandeld. De registratie van CIMAvax-EGF maakt het mogelijk om het uit te breiden tot alle patiënten in het land die werden gediagnosticeerd met gevorderde longkanker; daarmee is Cuba het eerste land ter wereld met een nationaal programma dat gebruik maakt van dit therapeutische alternatief. wat de economische voordelen betreft, hebben we door de onderhandelingen over dit Project 6,346 miljoen USD bereikt. De onderhandelingsstrategie van het project is gericht op de gezamenlijke ontwikkeling ervan met andere landen, wat betekent dat de buitenlandse tegenhanger de kosten van de klinische proeven in hun eigen land dekt, waardoor het betaalbaar wordt. Deze proeven vereisen investeringen van miljoenen USD, en dit is alleen mogelijk als het wordt ondersteund door buitenlandse tegenhangers. Tegelijkertijd biedt deze strategie meer klinische gegevens aan Cuba, zonder de kosten van het uitvoeren van de proeven hier. Tot nu toe zijn klinische proeven uitgevoerd in Canada, het Verenigd Koninkrijk en Maleisië. In de nabije toekomst zullen klinische proeven beginnen in China en Europa.
als onderdeel van deze licentiestrategie zijn de buitenlandse tegenhangers ook verantwoordelijk voor de productregistratie in de regio ‘ s waar zij commerciële rechten hebben. Tijdens de registratie-en marketingprocessen zal Cuba betalingen ontvangen voor mijlpalen en later als sales royalty ‘ s.
de wereldmarkt voor kankervaccins wordt geacht in de Orde van miljarden USD te liggen. Het feit dat Cuba een uniek product heeft voor geavanceerde longkanker behandeling kan ons voorzien van een exportpotentieel dat het gebruik van dit product in onze nationale gezondheidszorg kan financieren.
conclusies
vaccinatie met CIMAVAX-EGF is veilig, immunogeen en leidt tot een toename van de overleving met een goede kwaliteit van leven bij patiënten met longtumoren in een gevorderd stadium. Het ontwerp en de implementatie van een reguleringsstrategie voor de registratie van dit vaccin maakte het beschikbaar voor alle gevallen van gevorderde niet-kleincellige longkankerpatiënten in Cuba. Deze positieve ervaring kan van toepassing zijn op andere soortgelijke producten in uitvoering. Er werd een productieproces ontwikkeld, dat schaalbaar, consistent en reproduceerbaar was en voldeed aan de GMP-richtlijnen, om een product te genereren dat voldoet aan de specificaties. De ervaring met het onderhandelen over immateriële activa is zeer positief geweest, en heeft Amerikaanse middelen toegekend voor projectontwikkeling, terwijl het ondersteunen van de leerervaring die voortvloeit uit gezamenlijke werkzaamheden met de regelgevende instanties van verschillende landen.
dankbetuigingen
De auteurs willen de volgende specialisten van het Centrum voor Moleculaire Immunologie bedanken voor hun bijdrage aan dit werk.: Rolando Pérez, Loany Calvo, Suhamy Aandacht, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Cartroman, Sergio Proeven, Ana Veloso, Reinaldo Crow, Yanelda Lopez, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Hout, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Wastafel, Mayra Santaelena, Joaquin Solozabal, Aida Rodriguez, Maria Elena Garcia, Addis Torres, Eric Chong, Carmen Roll, Mauritius Catala, Soraida Acosta, Barbara Wilkinson, Olga Torres, Normando Iznaga alle van hen van het Centrum van Moleculaire Immunologie, en ook Daniel González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén , Vivian Pujol, Dinorah Torres van het Centrum voor genetische manipulatie en biotechnologie.
1. González G, Montero E, León K, Cohen IR, Lage A. Autoimmunization to Epidermal Growth Factor, a component of the im-munological homunculus. Autoimmun Rev 2002; 1: 89-95.
2. Lage a, Crombet T, González G. Targeting epidermal growth factor receptor Signal: early results and future trends in oncology. Ann Med 2003; 5 (35): 327-36.
3. González G en Lage A. kankervaccins voor Hormoonimmuundeprivatie: The EGF Vaccine Approach: Leading Topics in Cancer Research, Chapter 11, Ed Nova Publishers, 2007.
4. González G en Lage A. Cancer vaccines for hormone / growth factor immune deprivation: een haalbare aanpak voor kankerbehandeling. Curr Cancer Drug Targets 2007; 7: 229-41.
5. González G, Crombet T, Torres F, Catala M, Alfonso L, Osorio M, et al. Epidermale groeifactor-gebaseerd kankervaccin voor niet-kleincellige longkanker therapie. Ann Oncol 2003; 14: 461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Behandeling van NSCLC-patiënten met een op EGF gebaseerd kankervaccin. Verslag van een Fase I proef. Kanker Biol Ther 2006;5 (2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. Therapeutic vaccination with epidermal growth factor (EGF) in advanced lung cancer: analysis of gepoolde data from three clinical trials. Hum Vaccines 2007; 3 (1):8-13.
8. Neninger E, De La Torre A, Osorio M, Catald M, Bravo I, Mendoza M, et al. Fase II gerandomiseerde gecontroleerde studie van een epidermaal groeifactor vaccin bij Gevorderde niet-kleincellige longkanker. J Clin Oncol 2008;26:1452-8.
9. García B, Neninger E, De La Torre A, Leonard I, Martínez R, Viada C, et al. Effectieve remming van de epidermale groeifactor/epidermale groeifactor Receptorbinding door anti-epidermale groeifactor antilichamen is gerelateerd aan een betere overleving bij patiënten met gevorderde niet-kleincellige longkanker die behandeld worden met het epidermale groeifactor vaccin. Clin Cancer Res 2008; 14 (3):840-6.
10. Neninger E, Verdcia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. Het combineren van een op EGF gebaseerd kankervaccin met chemotherapie bij Gevorderde niet-kleincellige longkanker. J Immunother 2009; 32: 92-9.
11. A, A, A, A, A, A, A, A, A, A, A, A, A, et al. Ontwikkeling van het productieproces voor een op epidermale groeifactor gebaseerd kankervaccin. Bio-pharm Int, Vaccines Suppl, okt 2008.
Leave a Reply