Chemische binding
chemische bindingen zijn de aantrekkingen tussen atomen die ze bij elkaar houden om verbindingen te vormen. Er zijn drie belangrijke soorten binding: covalente bindingen die moleculaire verbindingen binden, ionische bindingen die zouten en Ionische kristallen binden, en metaalbindingen die de atomen van metalen binden.
moleculen en covalente bindingen
De meeste brandstoffen, kunststoffen en natuurlijke producten zijn moleculaire verbindingen, gemaakt van atomen die tot moleculen zijn gebonden. Het type binding dat de atomen van een molecuul verbindt is covalente binding, die optreedt wanneer de buitenste elektronen van twee atomen tussen hen worden gedeeld, waardoor een aantrekkingskracht tussen de twee atomen ontstaat.
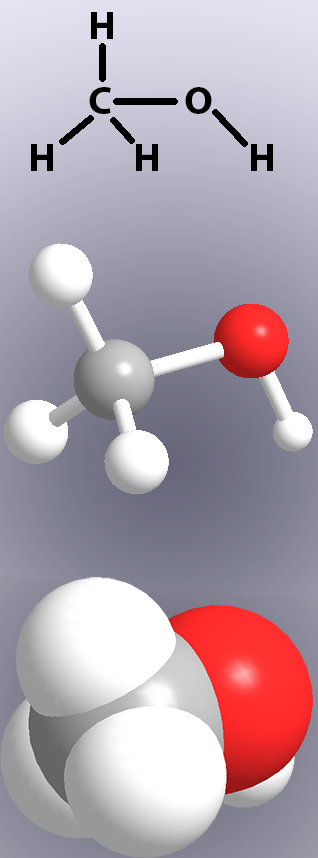
covalente bindingen worden in chemische structuren weergegeven door lijnen (figuur 1, boven) en in modellen door ofwel “sticks” aan te geven ofwel de overlapping van de atomen (figuur 1, Midden en onder).
de elektronen in een covalente binding worden niet altijd even gedeeld tussen de twee atomen. Wanneer het delen ongelijk is, zal één atoom een zeer lichte positieve lading hebben, en het andere atoom zal licht negatief zijn. Dit kratten een kleine elektrische dipool-moleculen die een dipool bevatten zijn polaire verbindingen. Of een molecuul polair of apolair is, heeft invloed op zijn eigenschappen, zoals smelt-en kookpunten en waterstofbinding.
Lees meer over covalente binding op de scheikundige LibreText.
Ionische en metallische binding
terwijl covalente binding inhoudt dat elektronen tussen twee atomen worden gedeeld, impliceert ionische binding de volledige overdracht van elektronen van het ene atoom naar het andere, waardoor positieve en negatieve ionen ontstaan. Deze ionen worden dan bij elkaar gehouden door de aantrekking tussen hun tegengestelde ladingen. Ionische verbindingen vormen kristallen op basis van deze attracties.
metaalbinding omvat het volledig Delen van de valentie-elektronen van metaalatomen, waardoor een “elektronenzee” ontstaat waarin elektronen vrij kunnen bewegen. Dit is een deel van de reden voor de hoge geleidbaarheid van metalen. Lees meer over metaalbinding op de Scheikunde LibreText
energie en chemische bindingen
in het algemeen zal energie vrijkomen wanneer een binding ontstaat tussen twee atomen, ongeacht het type binding. Evenzo, als er al een band bestaat tussen twee atomen, zal energie nodig zijn om het te breken. De hoeveelheid energie die nodig is om een band te breken is dezelfde als de hoeveelheid energie die vrijkomt wanneer het zich vormt.
De meeste chemische reacties betreffen zowel het breken als het maken van chemische bindingen. Als de energie die vrijkomt door het vormen van nieuwe bindingen groter is dan de energie die nodig is om de “oude” bindingen te breken, zal er in het algemeen energie vrijkomen door de reactie. Deze energie kan verloren gaan als warmte, of kan worden gebruikt voor energie.
bijvoorbeeld, de verbranding van methaan (CH4) volgt deze chemische reactie:
deze reactie bestaat uit het breken van de vier koolstof-waterstofbindingen in methaan en de zuurstof-zuurstofbinding in O2. Nieuwe bindingen zijn de twee koolstof-zuurstofbindingen (in CO2) en waterstof-zuurstofbindingen (in H2O). Deze nieuwe bindingen hebben over het algemeen minder energie dan de oorspronkelijke bindingen, dus energie zal vrijkomen door deze reactie. Het vrijgeven van energie is een kenmerk van verbrandings reacties – U kunt dit gemerkt hebben bij het voelen van een hete vlam. De animatie hieronder illustreert de koolwaterstofverbranding van methaan.
aangezien een grote hoeveelheid energie vrijkomt bij de vorming van CO2 en H2O bij de verbranding van koolwaterstoffen zoals methaan, zijn deze een goede primaire energiebron. Het betekent ook dat een grote hoeveelheid energie nodig zou zijn om de bindingen in CO2 te breken en andere moleculen te vormen. Dit is een van de redenen waarom fotosynthese zoveel energie (van zonlicht) nodig heeft om CO2 om te zetten in koolhydraten.
voor verdere lezing
- chemische energie
- verbranding
- primaire energie
- energieconversietechnologie
- of onderzoek een willekeurige pagina
Leave a Reply