Chemie: wat zijn zuren en basen?
Wat zijn zuren en basen?
hoewel ik je heb verteld dat zuren en basen niet moeilijk te begrijpen zijn, heb ik slecht nieuws: er zijn niet één maar drie gemeenschappelijke definities gebruikt om zuren en basen te beschrijven: Arrhenius zuren en basen, Brnsted-Lowry zuren en basen, en Lewis zuren en basen. Hoewel dit klinkt alsof je moet leren over zuren en basen drie keer, het goede nieuws is dat Voor vele praktische doeleinden, deze drie definities zijn ongeveer gelijkwaardig.
Arrhenius zuren en basen
ver terug in de late jaren 1800, onze oude vriend Svante Arrhenius kwam met definities van zuren en basen tijdens het werken aan kineticaproblemen.
volgens Arrhenius zijn zuren verbindingen die in water breken om hydronium (H+) – ionen af te geven. Een veel voorkomend voorbeeld van een Arrhenius-zuur is zoutzuur (HCl):
- HCl ? H+ + Cl –
de formules voor zuren beginnen meestal met waterstof, hoewel organische zuren een opmerkelijke uitzondering vormen. De namen en formules van een aantal veel voorkomende zuren zijn gegeven in de tabel hieronder:
| Zuur Naam | Formule |
|---|---|
| zoutzuur | HCl |
| salpeterzuur | HNO3 |
| fosforzuur | H3PO4 |
| zwavelzuur | H2SO4 |
| azijnzuur | C2H4O2 |
Arrhenius basen worden gedefinieerd als stoffen die de oorzaak zijn van de vorming van de hydroxide-ionen in het water. Een voorbeeld van een Arrhenius-base is natriumhydroxide (NaOH):
- NaOH ? Na+ + OH-
basen hebben meestal “OH” in hun formules, hoewel er uitzonderingen zijn. Ammoniak (NH3) bevat bijvoorbeeld geen hydroxide-ionen, maar vormt ze wanneer het reageert met water:
- NH3 + H2O ? NH4+ + OH –
de namen en formules van enkele gemeenschappelijke bases staan in de volgende tabel:
| basisnaam | formule | ammoniak | NH3 | kaliumhydroxide | KOH | natriumbicarbonaat | NaHCO3 |
|---|---|
| natriumcarbonaat | Na2CO3 | natriumhydroxide |
sommige oxiden vormen zuren of basen wanneer water wordt toegevoegd. Omdat deze verbindingen Geen H + of OH – ionen bevatten tenzij ze reageren met water, worden ze “anhydriden” genoemd.”Typisch, oxiden van niet-metalen zijn zuur anhydriden (ze vormen zuur wanneer geplaatst in water), en oxiden van metalen zijn base anhydriden (het vormen van een base wanneer geplaatst in water).
Brnsted-Lowry zuren en basen
in de vroege jaren 1900 werd een alternatieve definitie voor zuren en basen voorgesteld door Johannes Brnsted en Thomas Lowry om rekening te houden met het feit dat ammoniak de zuurgraad van HCl kan neutraliseren, zelfs als er geen water aanwezig is. Dit fenomeen toonde hen aan dat ammoniak een base is, zelfs als er geen water is om hydroxide-ionen te vormen.
Er zijn veel verschillende namen en formules gebruikt om het hydronium-ion te beschrijven. Hoewel de formule eerder werd getoond als “H+”, wordt het soms geschreven als “H3O” omdat dit het ion is dat wordt gevormd wanneer H+ met water combineert. Een andere veel voorkomende manier om te verwijzen naar hydronium ionen is gewoon om ze te noemen “protonen.”Deze naam komt van het feit dat H+ een waterstofatoom (één proton en één elektron) vertegenwoordigt dat zijn elektron heeft verloren, waardoor alleen het kale proton achterblijft.
een brnsted-Lowry-zuur wordt gedefinieerd als een verbinding die hydroniumionen aan een andere verbinding geeft?zoutzuur geeft bijvoorbeeld H+ – ionen aan verbindingen waarmee het reageert. Brnsted-Lowry basen zijn verbindingen die hydroniumionen kunnen accepteren?wanneer ammoniak een hydronium-ion uit HCl krijgt, vormt het het ammoniumion.
de volgende vergelijking geeft de reactie weer van een brnsted-Lowry zuur met een brnsted-Lowry base:
- HNO3 + NH3 ? NO3 – + NH4 +
in deze reactie gedraagt salpeterzuur zich als een zuur omdat het ammoniak een proton geeft. Ammoniak gedraagt zich als een base omdat het het proton uit salpeterzuur accepteert.
echter, als je naar de andere kant van de vergelijking kijkt, vinden we de nitraat-en ammoniumionen. Omdat het nitraation protonen uit het ammoniumion kan opnemen (om HNO3 te vormen), is het nitraation een zeer zwakke Brnsted-Lowry-base. Omdat het ammoniumion een extra proton heeft om af te geven (in dit geval aan het nitraation), is het een brnsted-Lowry zuur.
het nitraation is gebaseerd op het salpeterzuurmolecuul, dus we zeggen dat het de geconjugeerde base van salpeterzuur is. Het ammoniumion is ook het geconjugeerde zuur van ammoniak. Samen wordt een zuur met zijn geconjugeerde base (zoals HNO3 en NO3 -) of een base met zijn geconjugeerde zuur (zoals NH3 en NH4+) aangeduid als een geconjugeerd zuur-base paar.
Lewis zuren en basen
in de brnsted-Lowry definitie van zuren en basen wordt een base gedefinieerd als een verbinding die een proton kan accepteren. Maar hoe accepteert het het proton?
een eigenschap die brnsted-Lowry basen met elkaar gemeen hebben is dat ze een niet gedeeld paar elektronen hebben. Als er een hydronium-ion langs het molecuul komt zwerven, reiken de eenzame paren soms uit en grijpen het. Een voorbeeld hiervan is wanneer ammoniak een proton accepteert in een zure oplossing:
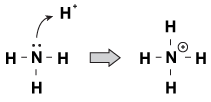
figuur 23.1 ammoniak kan een proton uit salpeterzuur halen met zijn eenzame paar elektronen.
een manier om naar dit proces te kijken is dat het ammoniakatoom zijn enige paar aan het proton doneert. Omdat de eenzame paren deze chemische reactie aansturen, hebben we een nieuwe definitie van zuurgraad en basiciteit, genaamd “Lewis zuurgraad/basiciteit.”Een Lewis base is een verbinding die een elektronenpaar doneert aan een andere verbinding (de ammoniak in ons voorbeeld). Een Lewis zuur is een verbinding die een elektronenpaar (het H+ ion in ons voorbeeld) accepteert.
Lewis-basen zijn chemische stoffen die elektronenparen kunnen doneren. Lewis zuren zijn chemicaliën die ze kunnen accepteren.
hoewel in ons voorbeeld ammoniak een enkel paar aan een proton doneerde, kan het eenzame paar in ammoniak ook met veel andere verbindingen reageren. Bijvoorbeeld, ammoniak kan zijn eenzame paar elektronen aan BH3 doneren door het volgende proces:

figuur 23.2 het eenzame paar op ammoniak dat zich aan BH3 hecht.
in dit proces is ammoniak De Lewis-base en BH3 het Lewis-zuur.
in het algemeen is de Lewis-definitie van zuren en basen het nuttigst omdat deze de meest inclusieve van de drie definities is. Bijvoorbeeld, de brnsted-Lowry definitie van een zuur omvat HF maar niet BH3, die niet verliest een proton wanneer bevestigd door de eenzame paren op een Lewis base.
uittreksel uit de Complete Idiot ‘ s Guide to Chemistry 2003 door Ian Guch. Alle rechten voorbehouden, met inbegrip van het recht op volledige of gedeeltelijke reproductie in welke vorm dan ook. Gebruikt in overleg met Alpha Books, lid van Penguin Group (USA) Inc.
om dit boek rechtstreeks bij de uitgever te bestellen, bezoek de website van Penguin USA of bel 1-800-253-6476. U kunt dit boek ook kopen bij Amazon.com en Barnes & Noble.
Leave a Reply