Biologie voor Majors I
leerresultaten
- Identificeer de componenten van eenvoudige chemische reacties
alle elementen zijn het meest stabiel wanneer hun buitenste schil is gevuld met elektronen volgens de octetregel. Dit komt omdat het energetisch gunstig is voor atomen om in die configuratie te zijn en het maakt ze stabiel. Echter, omdat niet alle elementen genoeg elektronen hebben om hun buitenste schillen te vullen, vormen atomen chemische bindingen met andere atomen waardoor ze de elektronen verkrijgen die ze nodig hebben om een stabiele elektronenconfiguratie te bereiken. Wanneer twee of meer atomen chemisch met elkaar binden, is de resulterende chemische structuur een molecuul. Het bekende watermolecuul, H2O, bestaat uit twee waterstofatomen en één zuurstofatoom; deze binden samen om water te vormen, zoals afgebeeld in Figuur 1. Atomen kunnen moleculen vormen door elektronen te doneren, te accepteren of te delen om hun buitenste schillen te vullen.
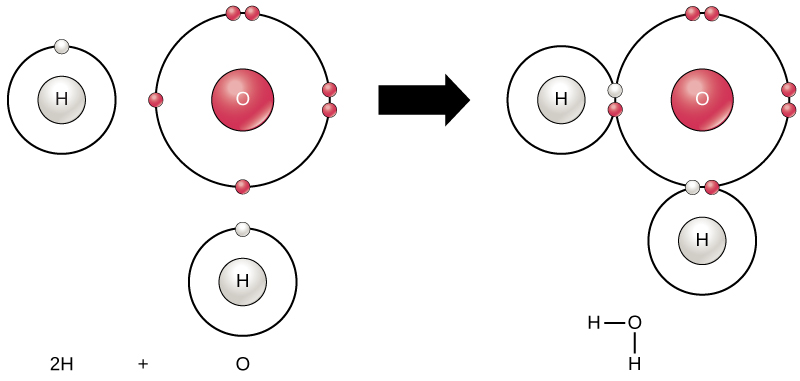
figuur 1. Twee of meer atomen kunnen zich met elkaar verbinden om een molecuul te vormen. Wanneer twee waterstof en een zuurstof via covalente bindingen elektronen delen, wordt een watermolecuul gevormd.
chemische reacties komen voor wanneer twee of meer atomen aan elkaar binden om moleculen te vormen of wanneer gebonden atomen uit elkaar worden gebroken. De stoffen die in het begin van een chemische reactie worden gebruikt, worden de reagentia genoemd (meestal gevonden aan de linkerkant van een chemische vergelijking), en de stoffen die aan het einde van de reactie worden gevonden, staan bekend als de producten (meestal gevonden aan de rechterkant van een chemische vergelijking). Een pijl wordt meestal getekend tussen de reagentia en producten om de richting van de chemische reactie aan te geven; deze richting is niet altijd een “eenrichtingsstraat.”Voor de creatie van het hierboven getoonde watermolecuul, zou de chemische vergelijking:
2H + O → H2O
een voorbeeld van een eenvoudige chemische reactie is de afbraak van waterstofperoxidemoleculen, die elk bestaan uit twee waterstofatomen gebonden aan twee zuurstofatomen (H2O2). De reactant waterstofperoxide wordt afgebroken in water, met een zuurstofatoom gebonden aan twee waterstofatomen (H2O), en zuurstof, die bestaat uit twee gebonden zuurstofatomen (O2). In de vergelijking hieronder, omvat de reactie twee waterstofperoxidemoleculen en twee watermoleculen. Dit is een voorbeeld van een gebalanceerde chemische vergelijking, waarbij het aantal atomen van elk element hetzelfde is aan elke kant van de vergelijking. Volgens de wet van behoud van materie moet het aantal atomen voor en na een chemische reactie gelijk zijn, zodat er onder normale omstandigheden geen atomen worden gecreëerd of vernietigd.
2H2O2 (waterstofperoxide) → 2H2O (water) + O2 (Zuurstof)
hoewel alle reagentia en producten van deze reactie moleculen zijn (elk atoom blijft gebonden aan ten minste één ander atoom), zijn in deze reactie alleen waterstofperoxide en water representatief voor een subklasse van moleculen die verbindingen worden genoemd: ze bevatten atomen van meer dan één type element. Moleculaire zuurstof daarentegen, zoals weergegeven in Figuur 2, bestaat uit twee dubbel gebonden zuurstofatomen en is niet geclassificeerd als een verbinding, maar als een element.
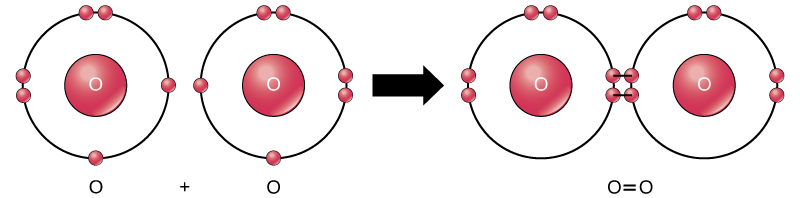
Figuur 2. De zuurstofatomen in een O2-molecuul zijn verbonden door een dubbele binding.
sommige chemische reacties, zoals hierboven weergegeven, kunnen in één richting doorgaan totdat de reagentia volledig zijn opgebruikt. De vergelijkingen die deze reacties beschrijven bevatten een unidirectionele pijl en zijn onomkeerbaar. Reversibele reacties zijn die welke in beide richtingen kunnen gaan. Bij reversibele reacties worden reagentia omgezet in producten, maar wanneer de concentratie van het product een bepaalde drempel overschrijdt (kenmerkend voor de specifieke reactie), worden sommige van deze producten weer omgezet in reagentia; op dit punt worden de benamingen van producten en reagentia omgekeerd. Dit heen en weer gaat door totdat er een bepaalde relatieve balans tussen reagentia en producten optreedt—een toestand die evenwicht wordt genoemd. Deze situaties van omkeerbare reacties worden vaak aangeduid door een chemische vergelijking met een tweekoppige pijl die naar zowel de reactanten als de producten wijst.
in menselijk bloed bijvoorbeeld binden overtollige waterstofionen (H+) zich aan bicarbonaationen (HCO3–), waardoor een evenwichtstoestand ontstaat met koolzuur (H2CO3). Als koolzuur aan dit systeem zou worden toegevoegd, zou een deel ervan worden omgezet in bicarbonaat en waterstofionen.
HCO3– + H+ ↔ H2CO3
bij biologische reacties wordt echter zelden een evenwicht bereikt omdat de concentraties van de reagentia of producten of beide voortdurend veranderen, vaak waarbij een product van de ene reactie een reactieve stof is voor een andere. Om terug te keren naar het voorbeeld van overtollige waterstofionen in het bloed, zal de vorming van koolzuur de belangrijkste richting van de reactie zijn. Het koolzuur kan echter ook het lichaam verlaten als kooldioxidegas (via uitademing) in plaats van terug te worden omgezet in bicarbonaat-ion, waardoor de reactie naar rechts wordt gestuurd door de chemische wet die bekend staat als de wet van massa-actie. Deze reacties zijn belangrijk voor het behoud van de homeostase van ons bloed.
HCO3 – + H + ↔ H2CO3 ↔ CO2 + H2O
in samenvatting: Chemische reacties en moleculen
de buitenste elektronenschil bepaalt hoe gemakkelijk en wat voor soort chemische bindingen een bepaald atoom zal vormen. De vorming van verbindingen wordt vaak visueel geschetst in chemische vergelijkingen die de reactanten tonen die deelnemen aan chemische reacties om producten te vormen.
probeer het
bijdragen!
verbeter deze pagina leer meer
Leave a Reply