6.4: ATP: adenosinetrifosfaat
vaardigheden om
- te ontwikkelen leg de rol van ATP als cellulaire energievaluta
- beschrijf hoe energie vrijkomt door hydrolyse van ATP
zelfs exergonische, energie-bevrijdende reacties vereisen een kleine hoeveelheid activeringsenergie om verder te gaan. Overweeg echter endergonische reacties, die veel meer energie nodig hebben, omdat hun producten meer vrije energie hebben dan hun reagentia. In de cel, waar komt energie om dergelijke reacties te voeden vandaan? Het antwoord ligt bij een energieleverend molecuul genaamd adenosine trifosfaat, of ATP. ATP is een klein, relatief eenvoudig molecuul (figuur \(\Paginindex{1}\)), maar binnen sommige van zijn bindingen, bevat het de mogelijkheid voor een snelle uitbarsting van energie die kan worden gebruikt om cellulair werk uit te voeren. Dit molecuul kan worden gezien als de primaire energievaluta van cellen op dezelfde manier dat geld de valuta is die mensen ruilen voor dingen die ze nodig hebben. ATP wordt gebruikt om de meerderheid van energie-vereisen cellulaire reacties aan te drijven.

zoals de naam al doet vermoeden, bestaat adenosine uit adenosine gebonden aan drie fosfaatgroepen (figuur \(\Paginindex{1}\)). Adenosine is een nucleoside die uit de stikstofhoudende basisadenine en een vijf-koolstofsuiker, ribose bestaat. De drie fosfaatgroepen, in volgorde van het dichtst aan het verst van de ribosesuiker, worden geëtiketteerd alfa, bèta, en gamma. Samen vormen deze chemische groepen een energiecentrale. Echter, niet alle bindingen binnen dit molecuul bestaan in een bijzonder hoge-energietoestand. Beide bindingen die de fosfaten verbinden zijn even energierijke bindingen (fosfoanhydride bindingen) die, wanneer ze verbroken worden, voldoende energie vrijgeven om een verscheidenheid aan cellulaire reacties en processen aan te drijven. Deze hoog-energetische bindingen zijn de bindingen tussen de tweede en derde (of bèta-en gamma -) fosfaatgroepen en tussen de eerste en tweede fosfaatgroepen. De reden dat deze bindingen worden beschouwd als “high-energy” is omdat de producten van dergelijke bindingen breken—adenosinedifosfaat (ADP) en een anorganische fosfaatgroep (Pi)—aanzienlijk lagere vrije energie dan de reactanten: ATP en een watermolecuul. Omdat deze reactie plaatsvindt met het gebruik van een watermolecuul, wordt het beschouwd als een hydrolysereactie. Met andere woorden, wordt ATP gehydrolyseerd in ADP in de volgende reactie:
net als de meeste chemische reacties is de hydrolyse van ATP naar ADP reversibel. De omgekeerde reactie regenereert ATP van ADP + Pi. Inderdaad, cellen vertrouwen op de regeneratie van ATP net zoals mensen vertrouwen op de regeneratie van uitgegeven geld door middel van een soort van inkomen. Aangezien de ATP-hydrolyse energie vrijmaakt, moet de ATP-regeneratie een input van vrije energie vereisen. De vorming van ATP wordt uitgedrukt in deze vergelijking:
twee belangrijke vragen blijven over met betrekking tot het gebruik van ATP als energiebron. Hoeveel vrije energie komt er precies vrij bij de hydrolyse van ATP, en hoe wordt die vrije energie gebruikt om cellulair werk te doen? De berekende ∆G voor de hydrolyse van één mol ATP in ADP en Pi is -7,3 kcal/mol (-30,5 kJ/mol). Aangezien deze berekening waar is onder standaardomstandigheden, zou worden verwacht dat er een andere waarde bestaat onder cellulaire omstandigheden. In feite, is de ∆G voor de hydrolyse van één mol van ATP in een levende cel bijna het dubbele van de waarde bij standaardvoorwaarden: 14 kcal/mol (-57 kJ/mol).
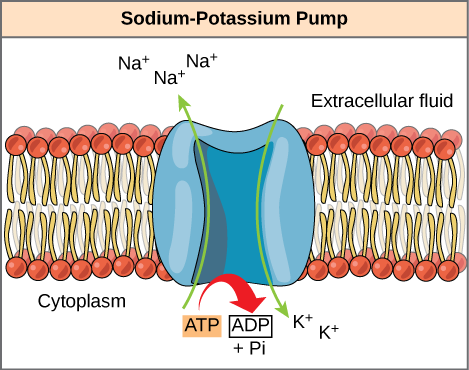
ATP is een zeer onstabiel molecuul. Tenzij het snel wordt gebruikt om werk uit te voeren, valt ATP spontaan uiteen in ADP + Pi en gaat de vrije energie die tijdens dit proces vrijkomt verloren als warmte. De tweede vraag die hierboven wordt gesteld, dat wil zeggen, hoe de energie die door ATP-hydrolyse wordt vrijgegeven wordt gebruikt om werk in de cel uit te voeren, hangt af van een strategie genoemd energiekoppeling. De cellen koppelen de exergone reactie van ATP hydrolyse met endergone reacties, toestaand hen om verder te gaan. Een voorbeeld van energiekoppeling die ATP gebruiken impliceert een transmembrane ionenpomp die voor cellulaire functie uiterst belangrijk is. Deze natrium-kaliumpomp (Na+/K+ pomp) drijft natrium uit de cel en kalium in de cel (figuur 6.4.2). Een groot percentage van ATP van een cel wordt besteed aan het voeden van deze pomp, omdat cellulaire processen veel natrium in de cel en kalium uit de cel brengen. De pomp werkt constant om de cellulaire concentraties van natrium en kalium te stabiliseren. Om ervoor te zorgen dat de pomp één cyclus draait (het uitvoeren van drie Na+ ionen en het importeren van twee K+ ionen), moet één molecuul van ATP worden gehydrolyseerd. Wanneer ATP wordt gehydrolyseerd, drijft het gammafosfaat niet gewoon weg, maar wordt het eigenlijk overgebracht op het pomproteïne. Dit proces van een fosfaatgroep die aan een molecuul bindt wordt phosphorylation genoemd. Zoals met de meeste gevallen van ATP-hydrolyse, wordt een fosfaat van ATP overgebracht op een andere molecule. In een phosphorylated staat, heeft de pomp Na+/K+ meer vrije energie en wordt teweeggebracht om een conformational verandering te ondergaan. Deze verandering staat het toe om Na+ aan de buitenkant van de cel vrij te geven. Het bindt dan extracellulaire K+, die, door een andere conformational verandering, Het Fosfaat veroorzaakt om van de pomp los te maken. Deze versie van fosfaat brengt K+ teweeg die aan de binnenkant van de cel moet worden vrijgegeven. In wezen is de energie die vrijkomt uit de hydrolyse van ATP gekoppeld aan de energie die nodig is om de pomp aan te drijven en de ionen Na+ en K+ te transporteren. ATP voert cellulair werk gebruikend deze basisvorm van energiekoppeling door phosphorylation uit.
de hydrolyse van één ATP-molecuul geeft 7,3 kcal/mol energie af (∆G = -7,3 kcal/mol energie). Als het 2,1 kcal/mol van energie vergt om één na + over het membraan te bewegen (∆G = + 2,1 kcal / mol van energie), hoeveel natriumionen zouden door de hydrolyse van één ATP molecuul kunnen worden bewogen?
vaak tijdens cellulaire metabole reacties, zoals de synthese en afbraak van nutriënten, moeten bepaalde moleculen lichtjes worden veranderd in hun bouw om substraten te worden voor de volgende stap in de reactiereeks. Een voorbeeld is tijdens de allereerste stappen van cellulaire ademhaling, wanneer een molecuul van de suiker glucose wordt afgebroken in het proces van glycolyse. In de eerste stap van dit proces, wordt ATP vereist voor phosphorylation van glucose, die een hoog-energie maar onstabiele tussenpersoon creëren. Deze phosphorylation reactie bevoegdheden een conformational verandering die de phosphorylated glucose molecule toestaat om in phosphorylated suiker fructose worden omgezet. Fructose is een noodzakelijk tussenproduct voor glycolyse om vooruit te gaan. Hier, wordt de exergonic reactie van ATP hydrolyse gekoppeld aan de endergonic reactie van het omzetten van glucose in een phosphorylated tussenpersoon in de weg. Opnieuw, werd de energie die door het breken van een fosfaatband binnen ATP wordt vrijgegeven gebruikt voor phosphorylation van een andere molecule, die tot een onstabiele tussenpersoon leiden en een belangrijke conformational verandering aandrijven.

zie een interactieve animatie van het ATP-producerende glycolyse-proces op deze site.
samenvatting
ATP is het molecuul dat primaire energie levert voor levende cellen. ATP wordt samengesteld uit een nucleotide, een vijf-koolstofsuiker, en drie fosfaatgroepen. De bindingen die de fosfaten verbinden (fosfoanhydride-bindingen) hebben een hoog energetisch gehalte. De energie die van de hydrolyse van ATP in ADP + Pi wordt vrijgegeven wordt gebruikt om cellulair werk uit te voeren. De cellen gebruiken ATP om werk uit te voeren door de exergone reactie van ATP hydrolyse met endergone reacties te koppelen. ATP doneert zijn fosfaatgroep aan een andere molecule via een proces dat als phosphorylation wordt bekend. De phosphorylated molecule is bij een hoger – energietoestand en is minder stabiel dan zijn unphosphorylated vorm, en deze toegevoegde energie van de toevoeging van het fosfaat staat de molecule toe om zijn endergonic reactie te ondergaan.
Art verbindingen
de hydrolyse van één ATP-molecuul geeft 7,3 kcal/mol energie af (∆G = -7,3 kcal / mol energie). Als er twee nodig zijn.1 kcal / mol van energie om één na + over het membraan te bewegen (∆G = + 2.1 kcal / mol van energie), hoeveel natriumionen zouden door de hydrolyse van één ATP molecuul kunnen worden bewogen?
drie natriumionen kunnen worden verplaatst door de hydrolyse van één ATP-molecuul. De ∆G van de gekoppelde reactie moet negatief zijn. De beweging van drie natriumionen door het membraan zal 6,3 kcal energie vergen (2,1 kcal × 3 Na+ ionen = 6,3 kcal). De hydrolyse van ATP verstrekt 7.3 kcal van energie, meer dan genoeg om deze reactie aan te drijven. De beweging van vier natriumionen over het membraan zou echter 8 vereisen.4 kcal van energie, kan meer dan één ATP molecuul verstrekken.
Bekijk de Vragen
De energie die vrijkomt bij de hydrolyse van ATP
- eerste plaats opgeslagen tussen de alfa-en beta-fosfaat
- gelijk aan -57 kcal/mol
- aangewend als warmte-energie door de cel tot het verrichten van werkzaamheden
- het leveren van energie aan gekoppelde reacties
D
Welke van de volgende moleculen is waarschijnlijk de meest potentiële energie?
- sucrose
- ATP
- glucose
- ADP
a
vrije respons
denkt u dat de EA voor ATP-hydrolyse relatief laag of hoog is? Leg je redenering uit.
de activeringsenergie voor hydrolyse is zeer laag. Niet alleen is ATP hydrolyse een exergonic proces met groot – ∆G, maar ATP is ook een zeer onstabiele molecule die snel in ADP + Pi breekt indien niet snel gebruikt. Dit suggereert een zeer lage EA omdat het zo snel hydrolyseert.
Woordenlijst
ATP, adenosine-trifosfaat, dat de cel energie munt phosphoanhydride bond bond die aangesloten fosfaten in een ATP molecuul
Medewerkers en Attributies
-
Connie Rogge (ten Oosten van de Mississippi Community College), Robert Wise (Universiteit van Wisconsin, Oshkosh), Vladimir Jurukovski (Suffolk County Community College), Jean DeSaix (Universiteit van North Carolina in Chapel Hill), Choi Jung (Georgia Institute of Technology), Yael Avissar (Rhode Island College) onder andere makers. Originele inhoud van OpenStax (CC BY 4.0; gratis downloaden op http://cnx.org/contents/185cbf87-c72…[email protected]).
Leave a Reply