3.4: Rutherford’ s Experiment – the Nuclear Model of the Atom
Atoms and Gold
in 1911 begonnen Rutherford en zijn collega ‘ s Hans Geiger en Ernest Marsden een reeks baanbrekende experimenten die het geaccepteerde model van het atoom volledig zouden veranderen. Ze bombardeerden zeer dunne vellen goudfolie met snel bewegende alfadeeltjes.

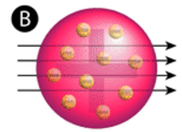
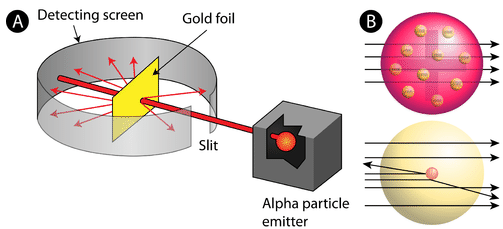
figuur \(\Paginindex{2}\) (A) de experimentele opstelling voor Rutherford ‘ s gold foil experiment: een radioactief element dat alfadeeltjes uitzond werd gericht op een dunne plaat goudfolie die werd omgeven door een scherm dat detectie van de afgebogen deeltjes mogelijk zou maken. (B) volgens het plum pudding model (top) zouden alle alfadeeltjes met weinig of geen doorbuiging door de goudfolie moeten zijn gegaan. Rutherford ontdekte dat een klein percentage alfadeeltjes werden afgebogen onder grote hoeken, wat kan worden verklaard door een atoom met een zeer kleine, dichte, positief geladen kern in het midden (bodem).
volgens het aanvaarde atoommodel, waarin de massa en lading van een atoom gelijkmatig over het atoom zijn verdeeld, verwachtten de wetenschappers dat alle alfadeeltjes door de goudfolie zouden gaan met slechts een lichte of helemaal geen doorbuiging. Verrassend genoeg, zoals getoond in Figuur \(\Pagindex{2}\) (terwijl de meeste alfadeeltjes inderdaad niet werden afgekeurd, stuiterde een zeer klein percentage (ongeveer 1 op de 8000 deeltjes) onder zeer grote hoeken op de goudfolie. Sommigen werden zelfs omgeleid terug naar de bron. Geen voorkennis had hen voorbereid op deze ontdekking. In een beroemd citaat riep Rutherford uit dat het was “alsof je een 15-inch shell op een stuk weefsel had afgevuurd en het kwam terug en raakte je.”
Rutherford moest met een geheel nieuw model van het atoom komen om zijn resultaten te verklaren. Omdat de overgrote meerderheid van de alfadeeltjes door het goud waren gegaan, redeneerde hij dat het grootste deel van het atoom lege ruimte was. De sterk afgebogen deeltjes moeten een enorme kracht in het atoom hebben ervaren. Hij concludeerde dat alle positieve lading en het grootste deel van de massa van het atoom moet worden geconcentreerd in een zeer kleine ruimte in het binnenste van het atoom, die hij de kern noemde. De kern is de kleine, dichte centrale kern van het atoom en bestaat uit protonen en neutronen.
Rutherford ‘ s atoommodel werd bekend als het nucleaire model. In het kernatoom bevinden de protonen en neutronen, die bijna de gehele massa van het atoom omvatten, zich in de kern in het centrum van het atoom. De elektronen zijn verdeeld rond de kern en bezetten het grootste deel van het volume van het atoom. Het is de moeite waard om te benadrukken hoe klein de kern is in vergelijking met de rest van het atoom. Als we een atoom konden opblazen ter grootte van een groot professioneel voetbalstadion, zou de kern ongeveer zo groot zijn als een knikker.
Rutherford ‘ s model bleek een belangrijke stap te zijn naar een volledig begrip van het atoom. Het ging echter niet volledig over de aard van de elektronen en de manier waarop ze de enorme ruimte rond de kern bezetten. Voor deze en andere inzichten kreeg Rutherford in 1908 de Nobelprijs voor de Scheikunde. Helaas had Rutherford liever de Nobelprijs voor de natuurkunde gekregen omdat hij de natuurkunde superieur vond aan de scheikunde. Naar zijn mening, “Alle wetenschap is ofwel fysica of Postzegel verzamelen.”
Leave a Reply