natriumhydroksidi
natriumhydroksidi kemialliset ominaisuudet,käyttö,tuotanto
kemialliset ominaisuudet
natriumhydroksidi on valkoinen, hajuton, haihtumaton emäksinen aine, jota markkinoidaan kiinteässä muodossa pelletteinä, hiutaleina, möhkäleinä tai tikkuina. Sen liukoisuus veteen on 111 painoprosenttia ja höyrynpaine 0mmHg (NIOSH, 1994).
se voi reagoida trikoloetyleenin (TCE) kanssa muodostaen syttyvää diklooriasetyleeniä ja metallien kanssa muodostaen vetykaasua (OEHHA, 1993). Sen reaktiivisuus metallien kanssa olisi otettava huomioon varastointiyksiköissä ja säiliöissä.
natriumhydroksidia on yleisesti saatavilla vesiliuoksena, joka tunnetaan kaustisena soodana, soodalipeänä tai yksinkertaisena lipeänä. Sillä on useita käyttötarkoituksia, kuten hapon neutralointi; paperin, Tekstiilien, muovien, syövyttävien aineiden, väriaineiden, maalin, maalinpoistoaineen ja saippuan valmistus; öljyn jalostus; galvanointi; metallin puhdistus; peseminen; ja astianpesuaineet. Metamfetamiinin laiton valmistus on yleistynyt.
käyttää
natriumhydroksidia (NaOH), joka on yksi hyödyllisimmistä teollisista natriumyhdisteistä. Se tunnetaan myös nimellä lipeä tai kaustinen sooda ja on yksi vahvimmista emäksistä emäksiä (korkea pH-arvo)kotitalouksien markkinoilla. Sitä käytetään viemäri-ja uuninpuhdistusaineena, ja se saippuan valmistuksessa saippuoituvat rasvat. Sitä on käytettävä varoen, koska se pystyy myös tuottamaan vakavia palovammoja.
kuvaus
natriumhydroksidi, joka tunnetaan myös nimillä lipeä ja kaustinen sooda, on erittäin syövyttävä aine, jota käytetään pieniä määriä kosmetiikassa tuotteen pH: n määrittämiseen ja pitämiseen.Natriumhydroksidi on erittäin tärkeä yhdiste elämässämme, koska sillä on niin monia käyttötarkoituksia. Se on hyvin yleinen kemianteollisuudessa käytetty pohja, ja sitä käytetään moniin asioihin, joista monet tapahtuvat jokapäiväisessä elämässämme. Natriumhydroksidin tunnetuimpia käyttökohteita on sen käyttö sulkuviemäreissä. Se tulee monia eri merkkejä Viemärin puhdistusaineita, mutta yksi yleisimmistä on Drano. Se tulee myös lipeäsaippuan muodossa, jolla voidaan pestä käytännössä mitä tahansa, astioista kasvoihin.
natriumhydroksidirakenne
huoneenlämpötilassa natriumhydroksidi on valkoista kiteistä hajutonta kiinteää ainetta, joka imee kosteutta ilmasta. Se on valmistettu aine. Natriumhydroksidi on epäorgaaninen yhdiste, jota käytetään pH-arvojen säätelyyn tai toimimaan puskurina kosmetiikassa ja hygieniatuotteissa. Sitä käytettiin historiallisesti saippuoiden muotoilussa, mutta nykyään sitä esiintyy useissa eri kaavoissa, kuten kylpytuotteissa, puhdistustuotteissa, tuoksuissa, jalkajauheissa, hiusväreissä ja-väreissä, meikeissä, kynsituotteissa, henkilökohtaisissa puhtaustuotteissa, shampoissa, parranajotuotteissa, depilaattoreissa, ihonhoitotuotteissa ja rusketustuotteissa sekä kemiallisissa hiusten suoristusaineissa ja hiusten aaltosarjoissa. Se on myös suosittu ainesosa teollisissa liuottimissa saippuoiden, uuninpuhdistusaineiden, pesuaineiden ja viemärinpuhdistusaineiden kemiallisena pohjana, koska se kykenee liuottamaan rasvaa, öljyjä, rasvoja ja proteiinipohjaisia talletuksia Wikipedian mukaan. Harvemmin natriumhydroksidia nähdään hammastahnojen ainesosana.
natriumhydroksidi on FDA: n hyväksymä, ja se on saanut Gras-luokituksen (yleisesti tunnustettu turvalliseksi) suoraksi elintarvikelisäaineeksi. Sitä käytetään kuitenkin pääasiassa tuotteiden pesuun ja kemialliseen kuorintaan. Se on hyväksytty käytettäväksi kosmetiikassa ja henkilökohtaisissa hoitotuotteissa vaihtelevina pitoisuuksina: 5 painoprosenttia kynsinauhojen liuottimissa, 2 painoprosenttia yleiseen käyttöön tarkoitetuissa hiusten suoristusaineissa, 4,5 painoprosenttia ammattikäyttöön tarkoitetuissa hiusten suoristusaineissa, enintään pH 12,7 depilaattoreissa ja enintään pH 11 muissa käyttötarkoituksissa pH: n säätöaineena.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
kemialliset ominaisuudet
natriumhydroksidi, NaOH,jota kutsutaan myös kaustiseksi soodaksi tai natriumhydraatiksi(ja aiemmin lipeäksi), on valkoinen,massiivinen, vetistyvä kiteinen kiinteä aine,joka liukenee veteen, alkoholiin ja glyseroliin. Se sulaa 318°C (606 ja) ja on yleisimmin käytetty ja saatavilla emäksinen kemikaali. Suurin osa natriumhydroksidista valmistetaan kloorin kopterina elektrolyyttikennojen avulla; kennot ovat kalvo -, elohopea-tai kalvotyyppisiä. Osa natriumhydroksidista on merkitty kennoissa tuotetuksi; suurin osa haihtuu ja myydään 50-ja 73-prosenttisina liuoksina tai vedettöminä helminä. Useimmissa kaustisissa käyttötarkoituksissa tarvitaan suhteellisen pieniä pitoisuuksia sisältäviä ratkaisuja. Kaustista soodaa käytetään analyyttisenä reagenssina ja kemiallisena välituotteena, pesu-ja puhdistusaltaissa,kumin talteenotossa ja öljynjalostuksessa, teräksen lämpökäsittelyyn tarkoitetuissa sammutusaltaissa,leikkaus-ja liukoisissa öljyissä,saippuoissa ja pesuaineissa sekä monissa muissa sovelluksissa.
kemialliset ominaisuudet
NaOH on valkoinen, hajuton, vetistyvä materiaali, jota myydään pelletteinä, hiutaleina, kokkareina tai tikkuina. Vesiliuokset tunnetaan soodalipeänä
kemiallisilta ominaisuuksiltaan
natriumhydroksidi esiintyy valkoisena tai lähes valkoisena fuusioituneena massana. Se on saatavilla pieniä pellettejä, hiutaleita, tikkuja ja muita muotoja tai muotoja. Se on kova ja hauras ja siinä on kiteinen murtuma. Natriumhydroksidi on hyvin vetistyvää ja altistuessaan ilmalle se sitoo nopeasti hiilidioksidia ja vettä.
fysikaaliset ominaisuudet
valkoiset ortorombiset kiteet, jotka on valmistettu pelletteinä, kokkareina, tikkuina, helminä, lastuina, hiutaleina tai liuoksina; hygroskooppinen; erittäin syövyttävä; imee nopeasti hiilidioksidia ja vettä ilmasta; tiheys 2,13 g/cm3; sulaa 323°C: ssa; höyrystyy 1388°C: ssa; höyrynpaine 1 torr 739°C: ssa ja 5 torr 843°C: ssa; liukenee erittäin hyvin veteen (110 g/100 ml huoneenlämmössä), lämmön tuottaminen liukenemisessa; vesiliuokset erittäin emäksisiä, 0,5% liuoksen pH noin 13 ja 0,05% liuoksen pH noin 12; liukenee metanoliin, etanoliin ja glyseroliin (23,8 g/100 ml metanolia ja 13.9 g/100 mL etanolia ympäristön lämpötilassa.).
käyttää
Kaustinen sooda on yksi käytetyimmistä kemikaaleista. Sitä käytetään happojen neutraloimiseen, natriumsuolojen valmistukseen, metallien saostamiseen niiden hydroksideiksi, öljynjalostukseen, estereiden saippuointiin, selluloosan, muovien ja kumin käsittelyyn sekä lukuisiinsynteettisiin ja analyyttisiin sovelluksiin.
käyttää
natriumhydroksidia myydään kaupallisesti vedettöminä hiutaleina tai pelletteinä tai 50-tai 73-prosenttisina vesiliuoksina. Sillä on lukemattomia teollisia käyttötarkoituksia, ja se on yksi maailman 10 tärkeimmästä kemikaalista tuotannon ja käytön suhteen. Natriumhydroksidia käytetään vuosittain noin 15 miljoonaa tonnia. Sen suurin käyttökohde, joka kuluttaa noin puolet sen tuotannosta, on pohjana muiden kemikaalien valmistuksessa. Sitä käytetään pH: n säätelyyn ja happojen neutralointiin kemiallisissa prosesseissa. Paperiteollisuus käyttää runsaasti natriumhydroksidia selluprosessissa. Natriumhydroksidia käytetään kuitujen erottamiseen liuottamalla yhdistävä ligniini. Sitä käytetään vastaavalla tavalla valmistettaessa raionia selluloosasta. Natriumhydroksidi on saippuan keskeinen kemikaali industry.In saippuoitumisprosessissa eläimistä ja kasveista saatavat triglyseridit kuumennetaan abasiittiliuoksessa, jolloin saadaan glyserolia ja saippuaa:
natriumhydroksidia käytetään tekstiiliteollisuudessa valkaisuun ja Tekstiilien käsittelyyn, jotta ne värjäytyvät helpommin. Öljyteollisuus käyttää natriumhydroksidia porauksessa mud-ja ASA-bakteerimyrkkynä. Natriumhypokloriittia (NaOCl) käytetään laajasti puhdistukseen ja desinfiointiaineena.Yhteinen kotitalouksien valkaisuaine koostuu noin 5% natriumhypokloriittiliuoksesta. Natriumhypokloriittia valmistetaan reagoimalla klooria natriumhydroksidin kanssa: Cl2(g) + 2NaOH(aq) →NaOCl(aq) + NaCl(aq) + H2O(l). Natriumhydroksidia käytetään elintarviketeollisuudessa hedelmien ja vihannesten puhdistamiseen ja kuorimiseen. Natriumhydroksidi on vähäinen ainesosa monissa tavallisissa kotitaloustuotteissa, mutta muutamissa se voi muodostaa yli puolet tuotteesta. Dranokrystaalit sisältävät 30-60% natriumhydroksidia ja jotkut viemärinpuhdistusaineet voivat koostua 100% natriumhydroksidista.
käyttää
natriumhydroksidia on veteen liukeneva emäs, jonka liukoisuus on 1 g 1 ml: aan vettä. sitä käytetään tuhoamaan oliivien kitkerät kemikaalit, joista tulee mustia oliiveja. se toimii myös neutraloida happoja eri elintarvikkeiden.
käyttää
natriumhydroksidia tuotteen pH: n säätämiseen, jotta se olisi iholle hyväksyttävämpi. Siitä käytetään yleisesti nimitystä kaustinen sooda, ja se toimii usein kemiallisena reagenssina saippuan valmistuksessa. Liian väkevöitynä se voi aiheuttaa voimakasta ihoärsytystä.
käyttää
natriumhydroksidia, joka on yksi tärkeimmistä teollisuuskemikaaleista. Määrällisesti se on Yhdysvalloissa tuotettujen kemikaalien kymmenen parhaan joukossa. Sitä käytetään useiden yhdisteiden, kuten useiden natriumsuolojen, valmistuksessa, selluloosan käsittelyssä raionin ja sellofaanin valmistukseen sekä saippuoiden, pesuaineiden, massan ja paperin valmistuksessa. Natriumhydroksidi on yleinen happojen neutralointiaine happo-emästitrauksissa ja maaöljyn jalostuksessa. Toinen merkittävä käyttökohde on metallien uuttaminen niiden malmeista, joissa malmien avaamiseksi käytetään usein alkali-fuusiota, kuten fuusioitumista kaustisen soodan kanssa. Lisäksi natriumhydroksidia käytetään metallien saostamiseen hydroksideina. Muita käyttökohteita ovat kumin talteenotto, kaseiinin liuottaminen muovin valmistuksessa, kasviöljyjen jalostus, Tekstiilien käsittely, eluanttina ionikromatografiassa, etsaus-ja galvanointireagenssina sekä laboratorioreagenssina. Natriumhydroksidia käytetään myös vahvana emäksenä monissa orgaanisissa synteeseissä ja emäskatalysoiduissa reaktioissa.
käyttää
NaOH-liuoksia happojen neutraloimiseen ja natriumsuolojen valmistukseen, esim. öljynjalostuksessa rikki-ja orgaanisten happojen poistamiseksi, selluloosan käsittelyyn viskoosin ja sellofaanin valmistuksessa, kumin talteenottoon kankaan liuottamiseksi; valmistettaessa muoveja kaseiinin liuottamiseksi. NaOH-liuokset hydrolysoivat rasvoja ja muodostavat saippuoita; ne saostavat suolojensa vesiliuoksista alkaloideja (emäksiä) ja useimpia metalleja (hydroksideina). Farmakoterapeuttinen apu (alkalisaattori).
valmiste
natriumhydroksidia valmistetaan yhdessä kloorin kanssa elektrolyysillä natriumkloridiliuosta. Erilaisia elektrolyyttikennoja käytetään kaupallisesti. Niitä ovat elohopeakenno, kalvosolu ja kalvosolu.
tyydyttynyt suolaliuos elektrolysoidaan. Kloorikaasu vapautuu anodilla ja natriumioni katodilla. Veden hajoaminen tuottaa vety-ja hydroksidi-ioneja. Hydroksidi-ioni yhdistyy natriumionin kanssa muodostaen NaOH: ta. Elektrolyyttiset kokonaisreaktiot voidaan esittää seuraavasti:
2na + + 2cl – + 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
elohopeakenno etenee kahdessa vaiheessa, jotka tapahtuvat erikseen kahdessa solussa. Ensimmäinen tunnetaan suolasoluna tai primaarielektrolysaattorina, jossa natriumioniesiintyy elohopeakatodilla muodostaen amalgaamia, kun taas kloorikaasu vapautuu anodilla:
Na + + Cl-→ Na-Hg (katodi) + ½Cl2(g) (anodi)
toisessa kennossa eli hajottajakennossa käytetään grafiittikatodia natriumamalgaamin toimiessa anodina. Vesi reagoi hajottajassa olevan amalgaamin natriummetallin kanssa:
Na-Hg + H2O → Na+ + OH– + ½H2 + Hg
kloori-alkalikalvosoluissa käytetään kalvoa erottamaan anodilla vapautunut kloori katodilla syntyvästä natriumhydroksidista ja vedystä. Ilman kalvoa muodostunut natriumhydroksidi yhdistyy kloorin kanssa muodostaen natriumhypokloriittia ja kloraattia. Monissa soluissa käytetään asbestikalvoja tällaiseen erottamiseen. Kalvosoluja on monenlaisia.
natriumhydroksidia valmistetaan joko vedettömänä kiinteänä aineena tai 50-prosenttisena vesiliuoksena.
määritelmä
tärkein kaupallisuus.
valmistusmenetelmät
natriumhydroksidia valmistetaan elektrolyysillä suolavedestä käyttäen inerttejä elektrodeja. Kloori kehittyy kaasuna anodilla ja vedy kaasuna katodilla. Kloridi-ja vetyionien poistuessa liuokseen jää natrium-ja hydroksidi-ioneja.Liuos kuivataan kiinteän natriumhydroksidin tuottamiseksi.
toisessa menetelmässä käytetään Kellner-Solvay-solua. Tyydyttynyt natriumkloridiliuos elektrolysoidaan hiilianodin ja sen jälkeen tulevan elohopeakatodin välillä. Tässä tapauksessa natrium tuotetaan at thecathode sijaan vety, koska valmius ofsodium liukenee elohopeaa. Natrium-elohopea-amalgaami altistetaan vedelle ja natriumhydroksidiliuokselle.
reaktiot
natriumhydroksidi on voimakkaasti emäksistä ja voi reagoida happojen kanssa muodostaen suoloja ja vettä.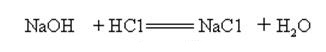
natriumhydroksidi reagoi happamien oksidien kanssa muodostaen suolaa ja vettä, joten natriumhydroksidia voidaan käyttää happamien kaasujen absorboimiseen laboratoriossa tai teollisesti.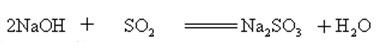
natriumhydroksidi voi reagoida monien metallisuolojen vesiliuosten kanssa muodostaen natriumsuoloja ja metallihydroksideja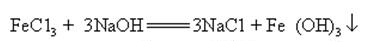
kun natriumhydroksidia ja ammoniakkisuolaa kuumennetaan yhdessä, se voi vapauttaa ammoniakkia 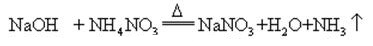
natriumhydroksidi on erittäin syövyttävää, jolloin natriumhydroksidiliuosta sisältävien lasipullojen on oltava kumitulppia, eikä lasitulppia saa käyttää estämään kemiallisen reaktion avautumista. Natriumhydroksidi on tärkeä teollisuuden raaka-aine, ja sitä voidaan valmistaa elektrolyysillä suolaliuosta teollisesti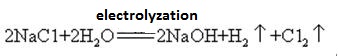
yleinen kuvaus
valkoinen kiinteä aine. Syövyttäviä metalleja ja kudoksia. Käytetään kemianteollisuudessa, öljynjalostuksessa, puhdistusaineissa, viemärinpuhdistusaineissa.
ilma & Vesireaktiot
Liukoinen veteen. Liukeneminen voi vapauttaa niin paljon lämpöä, että se aiheuttaa höyrystymistä ja roiskeita ja sytyttää viereisen palavan materiaalin .
Reaktiivisuusprofiili
kaustinen sooda (natriumhydroksidi) on vahva emäs. Reagoi nopeasti ja eksotermisesti sekä orgaanisten että epäorgaanisten happojen kanssa. Imee helposti kosteutta ilmasta, jolloin syntyy emäksisiä puolikiinteitä aineita, jotka hyökkäävät alumiinin ja sinkin kimppuun syttyvän vetykaasun kehittyessä. Katalysoi asetaldehydin ja muiden polymeroituvien yhdisteiden polymeroitumista; nämä reaktiot voivat tapahtua rajusti, esimerkiksi akroleiini polymeroituu äärimmäisen väkivaltaisesti joutuessaan kosketuksiin emäksisten aineiden kuten natriumhydroksidin kanssa . Reagoi erittäin väkivaltaisesti fosforipentoksidin kanssa, kun se käynnistetään paikallisella lämmityksellä . Kosketus (kuivausaineena) tetrahydrofuraanin kanssa, joka sisältää usein peroksideja, voi olla vaarallista—tällaisessa kemiallisesti samankaltaisen kaliumhydroksidin käytössä on tapahtunut räjähdyksiä . Kun johonkin seuraavista aineista sekoitettiin suljetussa astiassa, lämpötila ja paine nousivat: jääetikkahappo, etikkahappoanhydridi, akroleiini, kloorihydriini, kloorisulfonihappo, etyleenisyanohydriini, glyoksaali, suolahappo (36%), fluorivetyhappo (48,7%), typpihappo (70%), oleum, propiolaktoni, rikkihappo (96%) . Syövyttävän (todennäköisesti natriumhydroksidia sisältävän) puhdistusliuoksen ja Pentolin tahaton kosketus aiheutti voimakkaan räjähdyksen. . Metyylialkoholin ja triklooribentseenin seoksella kuumentaminen synteesissä johti äkilliseen paineen nousuun ja räjähdykseen . Kuuma ja / tai väkevä NaOH voi aiheuttaa hydrokinonin hajoamisen eksotermisesti korkeassa lämpötilassa. (NFPA Pub. 491M, 1975, 385)
Hazard
Corrosive to tissue in presence of mois-ture, strong irritant to tissue (eyes, skin, mucousmembranes, and ylähengitysteiden), poison by stioning.
terveysvaara
voimakas syövyttävä vaikutus kosketuksessa oleviin kudoksiin. Hengitys: pöly voi vahingoittaa ylähengitysteiden ja keuhkojen itse, tuottaa lievästä nenän ärsytystä pneumoniitti. Nieleminen: vakavia vaurioita limakalvoja; vaikea arpenmuodostus tai perforaatio voi esiintyä. Katsekontakti: aiheuttaa vakavia vaurioita.
terveysvaara
natriumhydroksidi on voimakkaasti syövyttävä aine, joka vahingoittaa ihmiskudoksia.Sen vaikutus iholla on hieman erilainenhapon palovammoja. Välitöntä kipua ei ole,mutta se tunkeutuu ihoon. Se ei koagulateproteiini estää sen edelleen tunkeutumista, ja siten syövyttävä polttaa voi tulla vakava ja hidas paraneminen. Valuminen sen keskittyneet ratkaisut silmiin voi johtaa vakavampaansiirtymiseen tai pysyvään vammaan.
se on myrkyllistä nieltynä sekä sen pölyn hengittämänä. Vaikka oraalinen myrkyllisyys OFA 5-10% liuosta kaustinen sooda todettiin olevan alhainen koe-eläimillä, suuret annokset suurempina pitoisuuksina voi aiheuttaa oksentelua, uupumus, ja romahtaa. Suun kautta otettavat letaalit dosein-kanit ovat 500 mg / kg (NIOSH 1986).
Natriumhydroksidipölyt tai-aerosolit kulkeutuvat silmiin, nenään ja nieluun. Pidentynyt altistuminen suurille pitoisuuksille ilmassa voi aiheuttaa nenäkäytävän haavaumia.
palovaara
palamaton aine itsessään ei pala, mutta voi hajota kuumennettaessa tuottaakseen syövyttäviä ja / tai myrkyllisiä kaasuja. Jotkut ovat hapettimia ja saattavat sytyttää palavia aineita (puu, paperi, öljy, vaatteet jne.). Kosketuksesta metallien kanssa voi kehittyä syttyvää vetykaasua. Astiat saattavat räjähtää kuumennettaessa.
syttyvyys ja räjähtävyys
natriumhydroksidi ja kaliumhydroksidi eivät ole syttyviä kiinteinä tai akveoussolumentteina.
farmaseuttiset Sovellukset
natriumhydroksidia käytetään laajalti lääkemuodoissa liuosten pH: n säätämiseksi. Sitä voidaan käyttää myös reagoimaan heikkojen aineiden kanssa muodostaen suoloja.
teollisuuskäytössä
kaustista soodaa (NaOH) pidetään vahvimpana emäksisenä pH: n säätelijänä. Syövyttävä Sodoma on erittäin vaikuttava aine ja erittäin syövyttävä. Suurin osa kaustinen sooda valmistetaanelektrolyysillä tyydyttyneitä briinejä (NaCl). Kaustisella soodalla on erittäin vahva pH-säätelykyky (ts. pH 7: stä pH 14: ään) suhteellisen pienellä annoksella verrattuna muihin emäksisiin aineisiin. Kaupallisesti kaustista soodaa on saatavilla vedettömänä, mutta useimmissa kaivossovelluksissa kaustinen sooda toimitetaan 50-prosenttisena liuoksena.
mineraalinjalostusteollisuudessa natriumhydroksidia käytetään lähinnä emäksisyyden säätelyyn ei-metallisten mineraalien käsittelyssä. Perusmetallien vaahdotuksessa natriumhydroksidin käyttö on harvinaista.
turvallisuusprofiili
myrkky vatsaontelonsisäisesti. Lievästi myrkyllistä nieltynä. Mutaatiotiedot ilmoitettu. Syövyttävä aine ärsyttää ihoa, silmiä ja limakalvoja. Kuumennettaessa hajoamaan se päästää myrkyllisiä nanohöyryjä.
turvallisuus
natriumhydroksidia käytetään laajalti lääke-ja elintarviketeollisuudessa, ja sitä pidetään yleisesti myrkyttömänä aineena matalissa pitoisuuksissa. Suurina pitoisuuksina se ärsyttää ihoa, silmiä ja limakalvoja.
LD50 (hiiri, IP): 0,04 g / kg
LD50 (kani, suun kautta): 0,5 g / kg
potentiaalinen altistuminen
NaOH: ta käytetään neutraloimaan happoja ja valmistamaan natriumsuoloja öljynjalostuksessa, viskoosia; sellofaania, muovin tuotannossa; ja niiden suolojen liuosten talteenotossa. Sitä käytetään valmistuksessa Merseroitu puuvilla, paperi, räjähteet, ja väriaineet metallin puhdistus; elektrolyyttinen uuttaminen sinkki; tina pinnoitus; oksidi pinnoite; pesu, valkaisu, astianpesu; ja sitä käytetään kemianteollisuudessa.
säilytys
näitä aineita käsiteltäessä on aina käytettävä roiskeläpiä ja läpäisemättömiä käsineitä silmä-ja ihokosketuksen estämiseksi. Metallihydroksidiliuokset, jotka voivat aiheuttaa aerosoleja, on tehtävä kaasussa, jotta estetään altistuminen hengitysteitse. NaOH ja KOH tuottavat melkoisesti lämpöä veteen liuetessa; kun sekoitat veteen, lisää aina syövyttäviä aineita hitaasti veteen ja sekoita jatkuvasti. Älä koskaan lisää vettä rajoitetusti solidhydroksideihin. Hydroksidisäiliöt on säilytettävä viileässä ja kuivassa paikassa erillään hapoista ja yhteensopimattomista aineista.
säilytys
natriumhydroksidi tulee säilyttää ilmatiiviissä ei-metallisessa säiliössä viileässä, kuivassa paikassa. Altistuessaan ilmalle natriumhydroksidi imee nopeasti kosteutta ja nesteyttää, mutta muuttuu myöhemmin jälleen kiinteäksi hiilidioksidin imeytymisen ja natriumkarbonaatin muodostumisen ansiosta.
Shipping
UN1823 NaOH, solid, Hazard class: 8; Labels: 8-Corrosive material. UN1824 NaOH, liuos, vaaraluokka: 8; merkinnät: 8-syövyttävä materiaali
puhdistusmenetelmät
Yleiset epäpuhtaudet ovat vesi ja natriumkarbonaatti. Natriumhydroksidia voidaan puhdistaa liuottamalla 100 g 1L puhdasta EtOH: ta ja suodattamalla liuos tyhjiössä hienon sintratun lasilevyn läpi liukenemattomien karbonaattien ja halidien poistamiseksi. (Tämä ja myöhemmät toimenpiteet on suoritettava kuivassa, CO2-vapaassa laatikossa.) Liuos konsentroidaan tyhjiössä miedolla kuumennuksella, jolloin monoalkoholaatista saadaan paksu liete, joka siirretään karkeaan sintrattuun lasilevyyn ja evakuoidaan ilman emäliuosta. Kun kiteet on pesty useita kertoja puhdistetulla alkoholilla veden poistamiseksi, ne kuivataan tyhjiössä, jossa on lievä lämmitys, noin 30 tuntia alkoholaatin hajottamiseksi, jolloin jäljelle jää hieno valkoinen kiteinen jauhe . Kaustinen. Natriumhydroksidiliuokset (Kaustinen), 14.77. Karbonaatti-ioni voidaan poistaa kulkemalla anioninvaihtopylvään läpi (esimerkiksi Amberliitti IRA-400; OH–muoto). Kolonni on valmistettava kloridimuodosta hitaasti ennen natriumhydroksidiliuosta, kunnes poistovedestä ei ole löytynyt kloridi-ioneja. Käytön jälkeen kolonni voidaan regeneroida pesemällä ensin laimealla HCl: llä, sitten vedellä. Vastaavasti muut metalli-ionit poistuvat, kun 1M (tai laimeampi) NaOH-liuos johdetaan Dowex-ioninvaihtopylvään A-1 läpi Na+ – muodossaan. Vaihtoehtoisesti karbonaattikontaminaatiota voidaan vähentää huuhtelemalla NaOH: ta (analyyttisen reagenssin laatu) nopeasti H2O: lla, liuottamalla sen jälkeen tislattuun H2O: hon tai valmistamalla NaOH: n väkevää vesiliuosta ja poistamalla kirkas kelluva neste. (Liukenematon Na2CO3 jää taakse.) Karbonaattikontaminaatiota voidaan vähentää lisäämällä hieman yli väkevää BaCl2-tai BA(OH)2-liuosta NaOH-liuokseen ravistamalla hyvin ja antamalla BaCO3-sakan laskeutua. Jos BA: n esiintyminen liuoksessa ei ole hyväksyttävää, voidaan käyttää elektrolyyttistä puhdistusta. Esimerkiksi natriumamalgaami valmistetaan elektrolyysillä 3L 30% NaOH 500 ml puhdasta elohopeaa katodille, ja platina-anodi, kulkee 15 Faradays at 4Amps, paksuseinäisessä polyeteenipullossa. Pullo on sitten varustettu tulo-ja poistoputkilla, jolloin käytetty liuos huuhdellaan pois CO2-vapaa N2. Tämän jälkeen amalgaami pestään huolellisesti suurella määrällä deionisoitua vettä (elektrolyysivirta kytketään päälle Na: n häviämisen minimoimiseksi). Lopuksi puhdas terästanko asetetaan kosketukseen liuoksessa amalgaamin kanssa (vedyn kehittymisen helpottamiseksi) ja reaktion annetaan jatkua, kunnes sopiva pitoisuus saavutetaan, ennen kuin se siirretään varastoastiaan ja laimennetaan tarpeen mukaan .
yhteensopimattomuudet
vahva emäs ja vahva hapetin. Väkivaltainen reaktio hapolla. Yhteensopimaton veden kanssa; Syttyvät nesteet; orgaaniset halogeenit, nitrometaani ja nitrosoundit, palavat aineet. Imee nopeasti hiilidioksidia ja vettä ilmasta. Kosketus kosteuden tai veden kanssa voi synnyttää lämpöä. Syövyttäviä metalleja. Kosketus sinkin, alumiinin, tinan ja lyijyn kanssa kosteuden läsnä ollessa, muodostaen räjähtävää vetykaasua. Hyökkää joitakin muoveja, kumia tai pinnoitteita.
yhteensopimattomuudet
natriumhydroksidi on vahva emäs, eikä se sovi yhteen minkään helposti hydrolyysin tai hapettumisen läpikäyvän aineen kanssa. Se reagoi happojen, estereiden ja eetterien kanssa erityisesti vesiliuoksessa.
Jätehuolto
tyhjennys vettä sisältävään säiliöön, neutraloidaan ja huuhdellaan sitten vedellä viemäriin.
Sääntelytilanne
GRAS lueteltu. Hyväksytty käytettäväksi elintarvikelisäaineena Euroopassa.Sisältyy FDA inaktiivisten ainesosien tietokantaan (dentaalivalmisteet; injektiot; inhalaatiot; nenän, oftalmiset, suun, suun,peräsuolen, paikallisesti, ja emättimen valmisteet). Sisältyy ei-vanhempiin ja parenteraalisiin lääkkeisiin, joilla on myyntilupa Yhdistyneessä kuningaskunnassa. Sisältyy Canadian luetteloon hyväksyttävistä Ei-lääkkeellisistä ainesosista.
Leave a Reply