mikä on jaksollisen järjestelmän reaktiivisin alkuaine?
fluori tunnistetaan jaksollisen järjestelmän reaktiivisimmaksi epämetalliksi ja elektronegatiivisimmaksi alkuaineeksi, mikä tekee siitä voimakkaimman hapettavan aineen. Cesium on jaksollisen järjestelmän reaktiivisin metalli siinä määrin, että tämän metallin kanssa työskentely päättyy usein räjähdyksiin!
mitä eräs kemisti sanoi toiselle huomatessaan tämän loukkaantuneen? ”Miksi natrium ahdistaa? Minusta sinä ylireagoit!”Näetkö, mitä tein? Joskus ihmettelen, miksi – hilpeydestäni huolimatta-minun on todella vaikea saada ystäviä …
muutenkin, huonojen arvosanojeni lisäksi ensimmäisenä kemiaa ajatellessani tulee mieleen labratakit, oudon muotoiset astiat, ikään kuin karnevaalipeilien heijastukset ja liekehtivät räjähdykset. Aina silloin tällöin joku mumisee ”reaktio” tai ”reaktiivisuus”, termejä niin kaikkialla, että heidät löytää soluttautumasta kemian kirjoihin viimeiselle sivulleen. Juuri tästä olemme nyt huolissamme.

vailla mitään teknistä ammattikieltä, ”reaktio” on juuri sitä, mitä se tarkoittaa, vastaus. Reaktiivisuus taas voidaan määritellä mittana sille, kuinka helposti kemiallinen laji osallistuu reaktioon ja muodostaa kemiallisia sidoksia. Niin, kysymys kuuluu-mikä elementti on helpoin yllyttää? Mutta ensin…
mikä määrittää alkuaineen reaktiivisuuden?
yksinkertaisesti sanottuna kemiallinen reaktio on ostajille ja myyjille täydellinen mahdollisuus ostaa ja myydä tavaroita. Ostajat ja myyjät ovat alkuaineita. Tavarat ovat elektroneja ja Vaihdettavana valuuttana on energia.
tämän kaupan tarkoituksena on saavuttaa stabiilisuus, optimaalinen elektronikonfiguraatio, joka saavutetaan, kun joko alkuaineen valenssi (uloin) kuori täytetään tai tyhjennetään kokonaan. Periaatteessa alkuaine voi ostaa lisää elektroneja täyttääkseen toiseksi viimeisen kuorensa tai myydä ne tyhjentääkseen sen.

mitä vähemmän elektroneja on mukana, sitä pienempi on energiakustannus. Jokainen, joka on perehtynyt luonnon säälimättömään toimintatapaan, arvaa, että vähiten energiaa vaativat kaupat ovat niitä, jotka todennäköisimmin tapahtuvat. Tämä on järkevää, koska alkuaine haluaisi menettää elektroneja ja tehdä itsensä tyhjäksi, jos sen uloin kuori on vähemmän kuin puoliksi täynnä, tai saada jonkin verran täyttääkseen itsensä, jos se on enemmän kuin puoliksi täynnä. Kuuden ostaminen, kun voi yksinkertaisesti menettää kaksi, olisi suorastaan typerää, mutta mikä tärkeintä, kallista!
näin ollen reaktiivisuus on funktio siitä, kuinka helposti alkuaine menettää tai saa elektroneja.
miten arvioimme elementin kannustimet?
Jaksollinen järjestelmä ja sen ”trendit”
miten saadaan selville, onko alkuaine ostaja vai myyjä? Viittaamme jaksolliseen järjestelmään.
Jaksollinen järjestelmä on muistutus siitä, että tiedemiehet ovat rajatilassa OCD: ssä eivätkä voi olla järjestämättä kaikkea äärimmäisen siistillä ja järjestetyllä tavalla. Jaksollinen järjestelmä järjestää kaikki tuntemamme alkuaineet yhteen kootulla tavalla.
taulukko järjestää alkuaineet niiden järjestysluvun mukaan, joka on sama kuin niiden sisältämien protonien tai elektronien lukumäärä. (Eikö ole outoa, että ne ovat yleensä täsmälleen samat?)
Trend 1
valenssikuoren elektronien määrä kasvaa yhdellä jäsennellessämme jokaisen alkuaineen läpi peräkkäin, vaikka kuorien lukumäärä pysyy samana. Kuorien lukumäärä voidaan päätellä rivinumerosta. Esimerkiksi jokainen toisen rivin elementti sisältää vain kaksi kuorta ja niin edelleen.
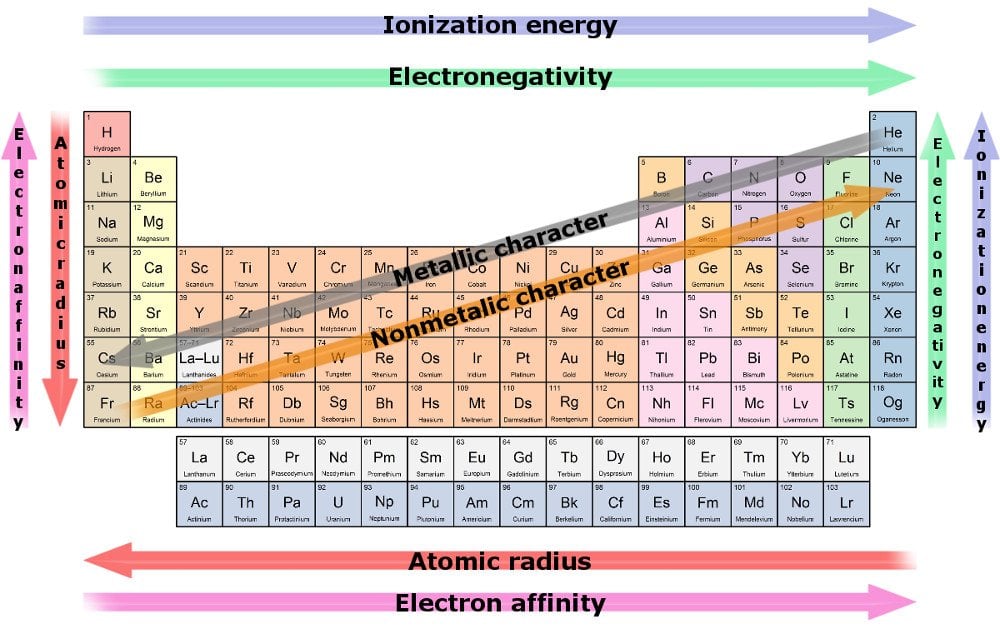
tämän suuntauksen seurauksena atomisäde pienenee, kun siirrymme kohti rivin viimeistä asukasta. Syynä on, että elektronien lisääntyminen peilautuu protonien lisääntymiseen keskustassa, kun taas ensin mainittujen on tunkeuduttava samaan kuoreen. Vetävien protonien ja lisääntyvien elektronien välisessä köydenvedossa ensin mainittu voittaa, mikä johtaa suurempaan ydinvoiman vetovoimaan vetäen kaikki kuorensa lähemmäksi sitä.
näin ollen vahvan vetovoiman vuoksi jokin alkuaine todennäköisemmin ostaa tai saa elektroneja, kun liikumme peräkkäin. Alkuaineen kykyä vetää elektroneja sitä kohti kutsutaan elektronegatiivisuudeksi. Elektronegatiivisin alkuaine on likimain se, joka varastaa elektroneja ja reagoi nopeimmin.
Trend 2
toinen trendi on alkuaineiden säde kasvaa, kun liikumme kolonnia alaspäin valenssielektronien määrän pysyessä samana, vaikka järjestysluku kasvaa koko ajan. Tämä johtuu siitä, että elektronien lisääntyminen on samansuuntainen kuorien lisääntymisen kanssa. Raskasmetalleilla on suurempi säde, erityisesti äärimmäisen pohjassa olevilla. Ne kuvaavat ydinenergian köyhintä vetovoimaa, ja näin ollen niillä on huono ote uloimpiin elektroneihinsa.

alkuaineen kyvyn menettää elektroneja mitta tunnetaan elektropositiivisuutena, ja se kasvaa siirryttäessä kolonnia alaspäin. Jälleen elektropositiivisin alkuaine on se, joka todennäköisimmin luopuu elektroneistaan ja reagoi nopeimmin.
nyt kun tiedämme säännöt, paljastetaan voittajat.
reaktiivisin epämetallifluori
fluori on halogeeniryhmän ensimmäinen alkuaine. Se on vaaleankeltainen, diatominen, erittäin syövyttävä, helposti syttyvä kaasu, jolla on pistävä haju. Sen järjestysluku on 9, ja sen valenssikuoressa on 7 elektronia. Lisäksi se sijaitsee toisella rivillä, mikä tarkoittaa, että kaikki sen 9 elektronia ovat jotenkin ahtautuneet vain 2 kuoreen.
7 elektronin valenssikuori vaatii sitä saamaan vain yhden elektronin viimeistelläkseen lopullisen kuorensa ja saavuttaakseen vakauden, mikä ei ole suuri saavutus, kun otetaan huomioon sen pieni koko ja voimakas ydinvoima. Fluori tunnistetaan jaksollisen järjestelmän elektronegatiivisimmaksi alkuaineeksi, mikä tekee siitä voimakkaimman hapettavan aineen. Se on kaikkein reaktiivisin Epämetalli.

fluori on niin reaktiivista, että se voi polttaa aineita, joita yleisesti pitäisi syttymättöminä! Se voi polttaa lasia, vettä ja jopa hiekkaa! Sen siveettömyys tekee mahdottomaksi varastoida tai eristää sitä puhtaimmassa muodossaan. Villin reaktiivisuutensa vuoksi sen varhainen eristäytymisen ja kokeilujen historia on täynnä kuolemaan johtaneita onnettomuuksia. Niin, kohtalokasta.
reaktiivisin metalli – cesium
cesium on kullanvärinen metalli, joka reagoi räjähdysmäisesti ilman ja veden kanssa. Sen järjestysluku on 55. Cesium sijaitsee ensimmäisessä sarakkeessa ja toiseksi viimeisellä rivillä. Kuten olemme keskustelleet, sarakkeen näin matalan elementin säde on melko suuri verrattuna edellä oleviin elementteihin.

(Kuvaluoto : Dnn87/Wikimedia Commons)
suuri säde tekee sen ydinvedosta tehottoman ja tekee siitä hirveän kömpelön. Suuren kokonsa vuoksi se on erittäin altis ionisoitumiselle. Se on erittäin herkkä ja luovuttaa helposti yhden elektronin valenssikuoressaan saavuttaakseen stabiiliuden, mikä tekee siitä erittäin reaktiivisen. Cesium on jaksollisen järjestelmän reaktiivisin metalli siinä määrin, että tämän metallin kanssa työskentely päättyy usein räjähdyksiin!
Francium
Francium on ensimmäisen sarakkeen viimeinen alkuaine, joka sijaitsee aivan cesiumin alapuolella, tehden siitä sarakkeen suurimman atomin. Loogisesti voisi päätellä, että Franciumilla on oltava parempi reaktiivisuus kuin cesiumilla, mutta näin ei ole.
on arvioitu, että sitä on maankuoressa korkeintaan yksi unssi kerrallaan. Koska sitä on luonnostaan niin vähän, tiedemiesten täytyy tuottaa sitä voidakseen tutkia sitä.

(Kuvaluoto : MarlonMarin1/Wikimedia Commons)
kuitenkin, vaikka se olisi jotenkin eristetty, se ei kestä kovin kauan. Francium on radioaktiivista, sen puoliintumisaika on vain 22 minuuttia, joten se hajoaa ennen kuin ehtii reagoida! Lisäksi niin monen protonin läsnäolo saa sen elektronit liikkumaan uskomattoman suurilla nopeuksilla. Kuten Einstein oivalsi, niin pienillä asteikoilla ja niin suurilla nopeuksilla alkaa tapahtua outoja asioita: elektronit käpertyvät hieman lähemmäksi ydintä kuin loogisesti voisi olettaa, jolloin niistä on hieman vaikeampi päästä eroon.
näyttää siis siltä, että Francium on reaktiivisin alkuaine, valitettavasti teoriassa.
juonipaljastuksia!
olet ehkä huomannut, että kaksi reaktiivisimpana pidettyä alkuainetta ovat voittajia vain omissa kategorioissaan — metallit ja epämetallit. Anteeksi, että olen ilonpilaaja, mutta lopullista vastausta siihen, kuka-on-reagoivin-Elementti-kaikkien joukossa-ei ole, koska tangoon tarvitaan kaksi.
voidaan kysyä, mikä alkuaine on reaktiivisin natriumin kanssa? Vastaus on siis fluori, ei cesium. Tai ehkä haluat tietää, mikä alkuaine reagoi parhaiten typen kanssa. Litiumia! Yllätys!
termi reaktiivisuus tulkitaan usein väärin. Kysymys on epäselvä ja hieman epätäydellinen, kuten tämä kirjoitus toivottavasti osoittaa.
Leave a Reply