kovalenttiset yhdisteet
sinulla on nyt lyhyt käsitys siitä, miksi eri alkuaineet käyttäytyvät eri tavoin. Mutta tiedätkö, että suuri osa siitä johtuu yhdisteissä olevien sidosten ”luonteesta”. Aivan kuten sinulla ja parhailla ystävilläsi on useita eroja ”sisäisten” ominaisuuksien vuoksi, niin on myös ionisten ja kovalenttisten yhdisteiden kohdalla. Tässä luvussa opimme lisää kovalenttisten yhdisteiden käsitteestä, tarkastelemme niiden ominaisuuksia ja paljon muuta.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Tämä johtuu siitä, että kovalenttisten molekyylien atomit ovat hyvin tiukasti koossa. Jokainen molekyyli onkin varsin erillinen ja kovalenttisen yhdisteen yksittäisten molekyylien välinen vetovoima on yleensä heikko.
molekyylien erottamiseen tarvitaan hyvin vähän energiaa. Tämä johtuu molekyylien välisistä puoleensavetävistä voimista, joilla ei ole yleistä sähkövarausta. Kovalenttiset yhdisteet ovat yleensä kaasumaisia molekyylejä huoneenlämpötilassa ja paineessa. Ne voivat olla myös nesteitä, joiden kiehumispiste on suhteellisen matala.
näiden ominaisuuksien voidaan katsoa johtuvan niiden heikoista molekyylien välisistä voimista, jotka pitävät näitä atomeja koossa. Meillä on kuitenkin myös paljon kiinteitä kovalenttisia yhdisteitä. Niillä on matalat sulamispisteet. On kuitenkin mielenkiintoista huomata, että pienellä osalla näistä on täysin erilainen rakenne. Ne muodostavat valtavia rakenteita, joissa valtava määrä atomeja pysyy koossa. Tämä on mahdollista, koska läsnä on jaettuja elektroneja.
nämä jättimäiset molekyylirakenteet ovat pohjimmiltaan kovalenttisen sidosrakenteen yhdessä pitämistä molekyyleistä koostuvia ristikoita. Nämä kovalenttiset sidokset ovat hyvin vahvoja. Ne ovat myös yleensä hyvin kovia korkeilla sulamispisteillä, jotka poikkeavat useimmista kovalenttisista yhdisteistä. Tällaisia kovalenttisia yhdisteitä ovat esimerkiksi hiiliatomiverkoston timantti ja grafiitti. Niihin kuuluu myös pii-ja happiatomien verkoston pii.
Download Chemical Bonding Cheat Sheet PDF klikkaamalla alla olevaa latauspainiketta


Selaa lisää aiheita kohdassa Kemiallinen sidos ja molekyylirakenne
- sidosparametrit
- kemiallisen sidoksen perusteet
- hybridisaatio
- vetysidos
- ioniset tai elektrovalentit yhdisteet
- molekyyliorbitaaliteoria
- sidosten polaarisuus
- resonanssirakenteet
- valenssisidos Teoria
- VSEPR-teoria
kovalenttisten yhdisteiden yleiset ominaisuudet
- kovalenttisilla yhdisteillä on yleensä matalat sulamispisteet. Poikkeuksena tähän ovat piidioksidimolekyylit ja timantit, joilla on korkea sulamispiste.
- näillä yhdisteillä on alhainen kiehumispiste. Tämän voidaan katsoa johtuvan niiden heikosta vetovoimasta eri sidottujen atomien välillä. Van Der Waalsin voimat sitovat näitä atomeja.
- nämä yhdisteet ovat yleensä kaasuja ja nesteitä, joilla on alhainen kiehumis-ja sulamispiste.
- kiinteillä kovalenttisilla yhdisteillä on pehmeät rakenteet kuten grafiitilla. Tämä johtuu siitä, että jokaisen hiiliatomikerroksen välissä on elektronipilvi.
- nämä yhdisteet eivät ole sähkövarauksen johtimia. Varattujen ionien puuttuminen on tärkein syy tähän. Poikkeuksena tästä on grafiitti, jossa näemme elektronipilven. Nämä tekevät grafiitista hyvän johtimen.
- ne ovat myös huonoja lämmönjohtimia. Niiden molekyyleistä puuttuu vapaita elektroneja ja se estää lämpöenergian kulkua.
- kovalenttisilla yhdisteillä ei ole yleisenä ominaisuutena polaarisia ominaisuuksia. Siksi nämä yhdisteet ovat veteen liukenemattomia. Vesimolekyylit eivät ole ehdottoman neutraaleja ja niillä on lievä negatiivinen varaus happiatomiin ja lievä positiivinen varaus vetyatomeihin ja koska kovalenttiset yhdisteet koostuvat neutraaleista molekyyleistä tai molekyyleistä, joilla on vähäisiä varauksia, eivätkä siten vetäydy vesimolekyyleihin voimakkaasti.
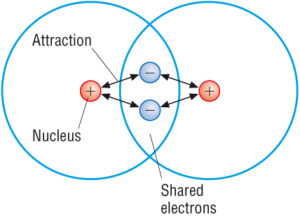
(lähde: Google)
Fysikaaliset ja kemialliset ominaisuudet
- nestemäiset kovalenttiset yhdisteet haihtuvat. Tällöin nesteiden ja kiintoaineiden molekyylit häviävät pinnaltaan ilmaan.
- näillä yhdisteillä on hyvin vähemmän affiniteettia molekyyliensä välillä.
- useilla kovalenttisilla yhdisteillä on omat tyypillisesti muotoillut molekyylinsä. Niiden sidokset on suunnattu ennalta asetettuihin kulmiin.
- eräät yhdisteet erityisesti lääkkeet liukenevat veteen. Loput liukenevat öljyyn.
- suurin osa kovalenttisista yhdisteistä on ei-polaarisia tai niillä on hyvin vähän taipumusta jakaantua kokonaan muodostaen ioneja eikä näin ollen koskaan johda sähköä.
- normaalissa lämpötilassa ja paineessa näitä yhdisteitä löytyy joko nesteinä tai kaasuina. Mutta on myös kiintoaineita ja niillä on suurempi molekyylipaino.
- kovalenttisia yhdistekiteitä on kahdenlaisia: sellaisia, joissa on heikko van der Waalin voima pitämässä näitä koossa kuten jodissa. Nämä ovat helposti sulavia ja haihtuvia toinen, jolla on suuri verkosto atomien perustaa makromolekyylejä.
- nämä yhdisteet liukenevat orgaanisiin liuottimiin kuten eetteriin ja bentseeniin.
- kovalenttiset sidokset ovat luonteeltaan suuntaisia. Siksi niissä esiintyy isomerismin ilmiö.
- kovalenttisilla yhdisteillä on pääasiassa hyvin hidas reaktionopeus, toisin kuin eri ioniyhdisteillä.
ratkaistuja esimerkkejä
kysymys: Miksi kovalenttiset yhdisteet eivät liukene veteen?
vastaus: vesimolekyylit eivät ole täysin neutraaleja. Näillä molekyyleillä on lievästi negatiivinen varaus happiatomissa ja lievästi positiivinen varaus vetyatomeissa. Toisaalta tiedetään, että kovalenttiset yhdisteet koostuvat neutraaleista molekyyleistä tai molekyyleistä, joilla on vähäisiä varauksia. Tästä syystä nämä yhdisteet eivät vetäydy vesimolekyyleihin voimakkaasti.
Leave a Reply