Kemiallinen sidos
kemialliset sidokset ovat atomien välisiä houkutuksia, jotka pitävät niitä yhdessä muodostaen yhdisteitä. Sidoksia on kolmea päätyyppiä: kovalenttisia sidoksia, jotka sitovat yhteen molekyyliyhdisteitä, ionisidoksia, jotka sitovat suoloja ja ionikiteitä, ja metallisidoksia, jotka sitovat metallien atomeja.
molekyylit ja kovalenttiset sidokset
useimmat polttoaineet, muovit ja luonnontuotteet ovat molekyyliyhdisteitä, jotka koostuvat atomeista, jotka ovat sitoutuneet toisiinsa molekyyleiksi. Molekyylin atomeja yhdistävä sidostyyppi on kovalenttinen sidos, joka tapahtuu, kun kahden atomin uloimmat elektronit jaetaan keskenään, jolloin syntyy vetovoima kahden atomin välille.
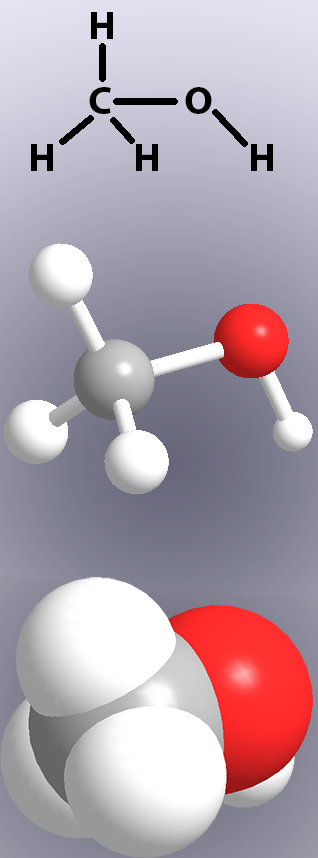
kovalenttiset sidokset esitetään kemiallisissa rakenteissa viivoilla (Kuva 1, yläosa) ja malleissa joko ”tikuilla” tai atomien päällekkäisyyksillä (Kuva 1, keski-ja alaosa).
kovalenttisen sidoksen elektronit eivät aina jakaudu tasan kahden atomin kesken. Kun jakaantuminen on epätasa-arvoista, toisella atomilla on hyvin lievä positiivinen varaus ja toisella atomilla on hieman negatiivinen. Tämä laatikot pieni sähköinen dipoli-molekyylit, jotka sisältävät Dipolin ovat polaarisia yhdisteitä. Se, onko molekyyli polaarinen vai ei-polaarinen, vaikuttaa sen ominaisuuksiin, kuten sulamis-ja kiehumispisteisiin sekä vetysidoksiin.
Lue lisää kovalenttisesta sidoksesta kemian Libretekstistä.
ioninen ja metallinen sidos
siinä missä kovalenttinen sidos merkitsee elektronien jakamista kahden atomin kesken, ioninen sidos merkitsee elektronien täydellistä siirtymistä atomista toiseen, jolloin syntyy positiivisia ja negatiivisia ioneja. Nämä ionit pidetään sitten yhdessä niiden vastakkaisten varausten välisen vetovoiman avulla. Ioniyhdisteet muodostavat kiteitä näiden vetovoimien perusteella.
metallisessa sidoksessa metalliatomien valenssielektronit jaetaan kokonaan, jolloin syntyy ”elektronimeri”, jossa elektronit liikkuvat vapaasti. Tämä on osasyy metallien korkeaan johtavuuteen. Lue lisää Metallisidoksista kemian Libretekstillä
Energia-ja kemiallisilla sidoksilla
yleensä energia vapautuu, kun kahden atomin välille muodostuu sidos, oli sidostyyppi mikä tahansa. Vastaavasti jos kahden atomin välillä on jo sidos, sen murtamiseen tarvitaan energiaa. Sidoksen katkeamiseen tarvittava energiamäärä on sama kuin sen muodostuessa vapautuva energiamäärä.
useimmissa kemiallisissa reaktioissa tapahtuu sekä kemiallisten sidosten katkeamista että muodostamista. Jos uusien sidosten muodostamisesta vapautuva energia on suurempi kuin ”vanhojen” sidosten katkaisemiseen tarvittava energia, energiaa vapautuu reaktiossa kokonaisuudessaan. Tämä energia voi kadota lämmöksi tai sitä voidaan käyttää voimaksi.
esimerkiksi metaanin (CH4) palaminen seuraa tätä kemiallista reaktiota:
tässä reaktiossa katkeavat neljä hiili-vety-sidosta metaanissa ja happi-happi-sidos O2: ssa. Uusia muodostuneita sidoksia ovat hiili-happi-sidokset (CO2: ssa) ja vety-happi-sidokset (H2o: ssa). Näillä uusilla sidoksilla on kaiken kaikkiaan vähemmän energiaa kuin alkuperäisillä sidoksilla, joten energiaa vapautuu tässä reaktiossa. Energian vapautuminen on palamisreaktioille ominaista-olet saattanut huomata sen, Kun tunnet kuuman liekin. Alla oleva animaatio havainnollistaa metaanin hiilivetypolttoa.
koska suuri määrä energiaa vapautuu hiilivetyjen kuten metaanin palamisessa muodostettaessa hiilidioksidia ja H2O: ta, nämä ovat hyvä primäärienergialähde. Se tarkoittaa myös sitä, että tarvitaan suuri määrä energiaa, jotta sidokset katkeaisivat CO2: ssa ja muodostaisivat muita molekyylejä. Tämä on yksi syy siihen, miksi yhteyttäminen vaatii niin paljon energiaa (auringonvalolta) CO2: n muuttamiseksi hiilihydraateiksi.
lisätietoja
- kemiallinen energia
- palaminen
- Primäärienergia
- energiakonversiotekniikka
- tai tutki satunnaista sivua
Leave a Reply