Kemia: Mitä ovat hapot ja emäkset?
mitä hapot ja emäkset ovat?
vaikka olen kertonut, että happoja ja emäksiä ei ole vaikea ymmärtää, minulla on huonoja uutisia: hapoille ja emäksille ei ole yhtä vaan kolmea yhteistä määritelmää: Arrheniuksen hapot ja emäkset, Brnsted-Lowryn hapot ja emäkset sekä Lewis-hapot ja emäkset. Vaikka tämä saa sen kuulostamaan siltä, että sinun on opittava hapoista ja emäksistä kolme kertaa, hyvä uutinen on, että monissa käytännön tarkoituksissa nämä kolme määritelmää ovat suunnilleen samat.
Arrhenius hapot ja emäkset
jo 1800-luvun lopulla Vanha ystävämme Svante Arrhenius keksi määritelmät hapoille ja emäksille työskennellessään kinetiikan ongelmien parissa.
Arrheniuksen mukaan hapot ovat yhdisteitä, jotka hajoavat vedessä muodostaen hydronium (H+) – ioneja. Yleinen esimerkki arrheniushaposta on suolahappo (HCl):
- HCl ? H+ + Cl –
happojen kaavat alkavat yleensä vedystä, joskin orgaaniset hapot ovat merkittävä poikkeus. Joidenkin tavallisten happojen nimet ja kaavat on esitetty alla olevassa taulukossa:
| hapon nimi | kaava |
|---|---|
| kloorivetyhappo | |
| typpihappo | HNO3 |
| fosforihappo | h3po4 |
| rikkihappo | H2SO4 |
| etikkahappo | c2h4o2 |
Arrhenius-emäkset määritellään yhdisteiksi, jotka aiheuttavat hydroksidi-ionin muodostumisen veteen joutuessaan. Yksi esimerkki Arrheniuksen emäksestä on natriumhydroksidi (NaOH):
- NaOH ? Na+ + OH –
emäksillä on kaavoissaan tyypillisesti ”OH”, joskin poikkeuksiakin on. Esimerkiksi ammoniakki (NH3) ei sisällä hydroksidi-ioneja, vaan muodostaa niitä reagoidessaan veden kanssa:
- NH3 + H2O ? NH4+ + OH –
joidenkin yhteisten emästen nimet ja kaavat ovat seuraavassa taulukossa:
| perusnimi | kaava |
|---|---|
| ammoniakki | NH3 |
| kaliumhydroksidi | |
| natriumbikarbonaatti | |
| natriumkarbonaatti | Na2CO3 |
| natriumhydroksidi | NaOH |
jotkut oksidit muodostavat happoja tai emäksiä vettä lisättäessä. Koska nämä yhdisteet eivät sisällä h+ – tai OH-ioneja, elleivät ne reagoi veden kanssa, niitä kutsutaan ”anhydrideiksi.”Tyypillisesti epämetallien oksidit ovat happoanhydridejä (ne muodostavat happoa veteen joutuessaan), ja metallien oksidit ovat emäsanhydridejä (muodostavat emäksen veteen joutuessaan).
Brnsted-Lowryn hapot ja emäkset
Johannes Brnsted ja Thomas Lowry ehdottivat 1900-luvun alussa vaihtoehtoista määritelmää hapoille ja emäksille selittääkseen, että ammoniakki voi neutraloida HCl: n happamuuden, vaikka vettä ei olisikaan. Ilmiö osoitti heille, että ammoniakki on emäs silloinkin, kun ympärillä ei ole vettä, joka muodostaisi hydroksidi-ioneja.
hydroniumionille on olemassa monia eri nimiä ja kaavoja. Vaikka kaava esitettiin aiemmin muodossa ” H+”, SE kirjoitetaan joskus nimellä” H3O”, koska tämä on ioni, joka muodostuu H+: n yhdistyessä veden kanssa. Toinen yleinen tapa viitata hydroniumioneihin on vain kutsua niitä ” protoneiksi.”Nimi tulee siitä, että H+ edustaa vetyatomia (yksi protoni ja yksi elektroni), joka on menettänyt elektroninsa jättäen jäljelle vain paljaan protonin.
Brnsted-Lowryhappo määritellään yhdisteeksi, joka luovuttaa hydroniumioneja toiselle yhdisteelle?esimerkiksi suolahappo antaa H + – ioneja yhdisteille, joiden kanssa se reagoi. Brnsted-Lowry emäkset ovat yhdisteitä, jotka voivat hyväksyä hydroniumioneja?kun ammoniakki saa Hydroniumionin HCl: stä, se muodostaa ammoniumionin.
seuraava yhtälö kuvaa brnsted-Lowry-emäksen kanssa tehdyn brnsted-Lowry-hapon reaktiota:
- HNO3 + NH3 ? NO3 – + NH4+
tässä reaktiossa typpihappo käyttäytyy happona, koska se luovuttaa protonin ammoniakille. Ammoniakki käyttäytyy emäksenä, koska se hyväksyy protonin typpihaposta.
kuitenkin, jos tarkastellaan yhtälön toista puolta, löydämme nitraatti-ja ammoniumionit. Koska nitraatti-ioni voi ottaa vastaan protoneja ammoniumionilta (jolloin muodostuu HNO3), nitraatti-ioni on hyvin heikko Brnsted-Lowry-emäs. Koska ammoniumionilla on ylimääräinen protoni luovutettavana (tässä tapauksessa nitraatti-Ionille), se on Brnsted-Lowry-happo.
nitraatti-ioni perustuu typpihappomolekyyliin, joten sanomme sen olevan typpihapon konjugaattiemäs. Samoin ammoniumioni on ammoniakin konjugaattihappo. Yhdessä happoa konjugaattiemäksineen (kuten HNO3 ja NO3-) tai emästä konjugaattihappoineen (kuten NH3 ja NH4+) kutsutaan konjugaattihappo-emäspariksi.
Lewis-hapot ja emäkset
brnsted-Lowryn happojen ja emästen määritelmässä emäs määritellään yhdisteeksi, joka voi hyväksyä protonin. Mutta miten se hyväksyy protonin?
yksi piirre, joka Brnsted-Lowry-emäksillä on yhteistä keskenään, on se, että niillä on pariton elektronipari. Kun hydroniumioni tulee vaeltamaan molekyylin mukana, joskus yksinäiset parit tarttuvat siihen. Esimerkki tästä on, kun ammoniakki hyväksyy protonin happamassa liuoksessa:
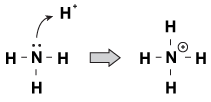
kuva 23.1 ammoniakki voi napata typpihaposta protonin yksinäisellä elektroniparillaan.
eräs tapa tarkastella tätä prosessia on, että ammoniakkiatomi lahjoittaa yksinäisen parinsa protonille. Koska yksinäiset parit ajavat tätä kemiallista reaktiota, meillä on uusi happamuuden ja emäksisyyden määritelmä, nimeltään ”Lewis acidity/basicity.”Lewis-emäs on yhdiste, joka lahjoittaa elektroniparin toiselle yhdisteelle (esimerkkitapauksessamme mainitulle ammoniakille). Lewis-happo on yhdiste, joka hyväksyy elektroniparin (esimerkissämme h+ – ioni).
Lewis-emäkset ovat kemikaaleja, jotka voivat luovuttaa elektronipareja. Lewis-hapot ovat kemikaaleja, jotka voivat hyväksyä ne.
vaikka esimerkissämme ammoniakki lahjoitti yksinäisen parin protonille, ammoniakissa oleva yksinäinen pari voi reagoida myös monien muiden yhdisteiden kanssa. Esimerkiksi ammoniakki voi luovuttaa yksinäisen elektroniparinsa BH3: lle seuraavalla prosessilla:

kuva 23.2 ammoniakin yksinäinen pari kiinnittyy BH3: een.
tässä prosessissa ammoniakki on Lewis-emäs ja BH3 on Lewis-happo.
yleisesti ottaen Lewisin määritelmä hapoille ja emäksille on hyödyllisin, koska se on kolmesta määritelmästä kaikkein kattavin. Esimerkiksi brnsted-Lowry-hapon määritelmä sisältää HF: n mutta ei BH3: a, joka ei menetä protonia, kun yksinäiset parit kiinnittyvät Lewis-emäkseen.
ote Ian Guchin teoksesta Complete Idiot ’ s Guide to Chemistry 2003. Kaikki oikeudet pidätetään, mukaan lukien kopiointioikeus kokonaan tai osittain missä tahansa muodossa. Käytetään järjestely Alpha Books, jäsen Penguin Group (USA) Inc.
Jos haluat tilata tämän kirjan suoraan kustantajalta, käy Penguin USA: n verkkosivuilla tai soita numeroon 1-800-253-6476. Voit myös ostaa tämän kirjan osoitteessa Amazon.com ja Barnes & Noble.
Leave a Reply