Epigenetiikka – kyse ei ole vain geeneistä, jotka tekevät meistä
joten mitä epigenetiikka on?
toinen tapa tarkastella epigenetiikkaa on tällainen; siinä missä perinteinen genetiikka kuvaa tapaa, jolla geeniemme DNA-sekvenssit siirtyvät sukupolvelta toiselle, epigenetiikka kuvaa geenien käytön periytymistä. Jos haluat tehdä tietokonevertauksen, ajattele epigenetiikkaa metatietona, informaationa, joka kuvaa ja määrää taustalla olevaa tietoa. Jos omistat MP3-soittimen esimerkiksi, se sisältää paljon dataa, MP3-tiedostoja. Ajattele, että nämä vastaavat geenejä. Mutta sinulla on myös todennäköisesti soittolistoja tai voit pelata kappaleita artisti tai genre. Nämä tiedot, soittolista, artisti, genre jne. on metadata. Se määrittää, mitkä kappaleet soitetaan ja missä järjestyksessä, ja tätä epigenetiikka on genetiikalle. Se on joukko prosesseja, jotka vaikuttavat siihen, mitkä geenit kytketään päälle eli” ilmaistaan”, kuten molekyylibiologit sanoisivat.
miten epigenetiikka vaikuttaa?
epigenetiikassa on siis kyse siitä, miten geenejä ilmaistaan ja käytetään, eikä itse geenien DNA-sekvenssistä, mutta miten tämä toimii? Monet tutkijat ovat tutkineet epigenetiikkaa viime vuosikymmeninä, ja se on tällä hetkellä intensiivisen tutkimustoiminnan alue. Tiedämme, että epigenetiikka toimii osittain lisäämällä ja poistamalla pieniä kemiallisia tunnisteita DNA: han. Voit ajatella näitä tägejä post-it-muistiinpanoina, jotka korostavat tiettyjä geenejä, joissa on tietoa siitä, pitäisikö ne kytkeä päälle vai pois päältä. Itse asiassa kyseistä kemiallista merkintää kutsutaan metyyliryhmäksi (KS.Kuva 1), ja sitä käytetään muuttamaan jotakin neljästä emäksestä eli ”kemiallisesta kirjaimesta”, A, C, T ja G, jotka muodostavat DNA: n geneettisen koodin. Merkittyä kirjainta kutsutaan C: ksi eli sytosiiniksi ja kun sitä muunnetaan eli metyloidaan, sitä kutsutaan 5-metyylisytosiiniksi. Metyyliryhmiä lisäävät DNA: han entsyymit, joita kutsutaan DNA-metyylitransferaaseiksi (DNMTS).
-
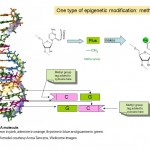
Kaavio 1. Kaksi kemiallista tagia, epigeneettisille ilmiöille keskeisiä metyyli-ja asetyyliryhmiä sekä sytosiinin ja 5-metyylisytosiinin kemiallinen rakenne DNA: ssa. Molekyylin viisikulmainen osa muodostaa DNA: n jatkuvan ”selkärangan”. Vain toinen tutun kaksoiskierteen muodostavista DNA-säikeistä näkyy.
Kuningatarmehiläisen status määräytyy osittain vähemmillä metyylitageilla
useimmissa tapauksissa jonkin geenin DNA: ssa oleva metyloituneempi Cs johtaa siihen, että geeni kytketään pois päältä. Mehiläiset antavat meille hyvän esimerkin siitä, miten tämä voi toimia. Työmehiläisillä ja kuningattarella on hyvin erilaiset ruumiit; kuningatar on paljon suurempi, pitkäikäisempi, sillä on laajentunut vatsa ja se munii tuhansia munia, kun taas pienemmät työntekijät ovat steriilejä, mutta heillä on monimutkaiset ravinnon etsintä-ja viestintätaidot. Tästä huolimatta kuningatar ja pesän työntekijät ovat naispuolisia ja geneettisesti identtisiä. Johtolanka siihen, miten tämä tapahtuu, on kuningatarhyytelössä, erityksessä, jota syötetään joillekin kehittyville toukille ja joka johtaa siihen, että näistä toukista tulee kuningattaria eikä työläisiä. Palaamme kuningatarhyytelöön ja sen kuningatarhyytelöön myöhemmin, mutta kiehtova tutkimus osoitti, että jos dnmt-entsyymiä lisäävän metyyliryhmän määrää vähennettiin keinotekoisesti mehiläisten toukissa, niin toukat kehittyivät kuningattariksi, vaikka niitä ei syötettäisi kuningatarhyytelöön. Kuningattaren ja työläisen välistä vaihtelua voi siis kääntää se, että mehiläisen toukkien DNA: ssa on runsaasti metyylilappuja. Vähemmän metyylilappuja johtaa siihen, että kehittyvissä toukissa on erityinen geeni tai geenejä, joiden seurauksena toukat kehittyvät kuningattariksi eivätkä työläisiksi.
tagit hännillä toimivat myös geenikytkimet
DNA-metyylitagit ovat kuitenkin vain yksi osa tarinaa. Kaikkien kasvien ja eläinten soluissa DNA pakataan tai kääritään nukleosomeihin, joissa DNA: n kaksoiskierre kietoutuu proteiinin keskusytimen ympärille (KS.kuva 2). Noin 150 kirjaimen edestä DNA: ta (tai emäspareja) kietoutuu jokaisen nukleosomin ympärille, ja tämä auttaa pakkaamaan 3 miljardia geneettisen koodin emäsparia jokaiseen soluumme. Nukleosomit ovat liian pieniä nähdäkseen tavanomaisilla mikroskoopeilla, mutta biologit käyttävät Röntgendiffraktioksi kutsuttua tekniikkaa selvittääkseen nukleosomien kaltaisten kappaleiden muodon ja organisaation, ja vuonna 1997 tämä tekniikka paljasti nukleosomien kauniin rakenteen korkealla resoluutiolla-Katso (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
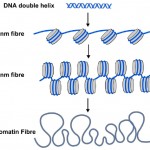
Kaavio 2. Tuttu DNA: n kaksoiskierre (sininen) kietoutuu nukleosomien (harmaiden sylinterien) ympärille soluissa. Nukleosomien naru voidaan kietoa paksummaksi filamentiksi, jota kutsutaan 30 nm: n kuiduksi, ja tämä voidaan edelleen kietoa vielä paksummaksi kromatiinikuiduksi. Kun geenit kytketään päälle, niiden nukleosomit ovat enemmän peittämättömiä kuin 10nm: n kuitu.
Nukleosomit ovat kompakteja, mutta nukleosomin muodostavien proteiinien päät eli ”hännät” eli histonit erottuvat muuten kompaktista nukleosomin rakenteesta. Kuten DNA: n metyylitunnisteet, myös näihin histonihäntiin voidaan lisätä pieniä kemiallisia tunnisteita (katso kuva 3). Kaksi näihin häntiin lisättävää kemiallista tunnistetta ovat asetyyliryhmät ja metyyliryhmät. Metyyliä, asetyyliä ja muutamia muita tunnisteita voidaan lisätä häntään lukuisina yhdistelminä, ja tämä vaikuttaa siihen, kytketäänkö taustalla oleva geeni päälle vai pois päältä. Itse asiassa geenit voidaan kytkeä pois päältä (tätä kutsutaan hiljentämiseksi), kokonaan päälle, tai jossain välissä DNA metyyli tunnisteet ja Histoni hännän tunnisteet. DNA-ja histonitunnisteiden yhdistelmä voi myös vaikuttaa siihen, kuinka helposti geeni kytkeytyy päälle tai pois päältä.
-
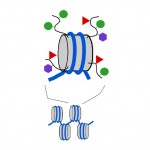
kaavio 3. Nukleosomeja muodostavien histoniproteiinien ”häntiin” voidaan lisätä kemiallisia tunnisteita. Harmaa lieriö, nukleosomi; kaarevat mustat viivat, histonihännät; vihreät ympyrät, metyylilaput; punaiset kolmiot, asetyylilaput; mauve-kuusikulmiot, muunlaiset tägit.
kun solut jakautuvat
kun solut jakautuvat, koko DNA-jakso alkuperäisestä solusta (3 miljardia emäsparia 23 kromosomiparissa ihmissolussa) kahdentuu niin, että molemmat tytärsolut saavat tarkan kopion. Mitä epigeneettisille tageille tapahtuu? Olemme tienneet jo jonkin aikaa, että myös DNA-metyyli-tunnisteet kopioidaan, niin että molemmilla tytärsoluilla on sama DNA: n metylaatiokuvio. Tiedämme nyt, että histonitunnisteiden malli on myös enimmäkseen kahdentunut solujen jakautuessa, vaikka tämä on tällä hetkellä huonommin ymmärretty. Solujen jakaantuminen on kuitenkin myös aikaa, jolloin epigeneettiset tunnisteet ovat helpoimmin muutettavissa.
pitkäikäisen madon paluu
heti alussa törmäsimme tarinaan pitkäikäisistä mikroskooppisista madoista, jotka säilyivät pitkäikäisinä jälkeläisilleen, vaikka yksittäiset jälkeläiset eivät perineet muunnosgeeniä (mutaatiota), joka alun perin aiheutti pidentyneen eliniän. Voimme nyt selittää tämän ilmeisen oudon tuloksen. Useimmissa tapauksissa geenit sisältävät informaation proteiinimolekyylin valmistamiseksi, ja proteiinimolekyylit saattavat olla entsyymejä, jotka suorittavat kemiallisia reaktioita solussa, tai osia solun rakenteesta itse. Kävi ilmi, että matotutkimuksessa mutatoituneet geenit muodostavat proteiineja, jotka yhdessä lisäävät nukleosomeihin metyylilappua. Tämä merkki on kytkinlaite. Kun yksi tai useampi geeneistä mutatoitui, tämä tunniste puuttui ja useat geenit, joiden pitäisi olla päällä, mukaan lukien osa ikääntymiseen osallistuvista, kytkettiin pois päältä ja madoilla oli pidempi elinikä. Odottamaton asia on, että epigeneettiset tunnisteet ajateltiin kokonaan poistaa tai nollata aikana muodostumista siittiöiden ja munasolun, joten toisin kuin geenit itse niitä ei pitäisi siirtää seuraavalle sukupolvelle. Mutta tämä tulos ja muut tutkimukset, jotka osoittavat, että näin ei aina ole ja että joskus, malli epigeneettiset tunnisteet siirretään.
kuningattaren tekeminen
se, tuleeko toukkahunajasta työläinen vai kuningatar, riippuu epigeneettisestä kytkimestä, ja tämä kytkin näyttää olevan kuningatarhyytelön ”kääntämä”. Mutta mikä kuningatarhyytelössä on vienyt toukan, joka muuten kasvaisi työläiseksi, kuningattareksi? Vastaus löytyy sen ymmärtämisestä, että solu tarkistaa jatkuvasti nukleosomien histonihäntiin lisättäviä yksittäisiä kemiallisia tunnisteita. Asetyylilappuja lisäävät entsyymit, joita kutsutaan histoniasetyylitransferaaseiksi, ja ne poistetaan tai poistetaan toisella entsyymiryhmällä nimeltä histoniasetylaasit (HDACs). Molemmat näistä entsyymeistä ovat läsnä useimmissa soluissa ja tämä mahdollistaa geenien kytkemisen päälle tai pois päältä ajan myötä.
Lisää asetyylitunnisteita auttaa toimittamaan queen bee status
äskettäin tutkijat lähtivät tunnistamaan yhdisteitä royal jelly, jotka voivat muuttaa tätä prosessia, ja mitä he löysivät oli jotain tunnetaan HDAC-estäjä. Tämä oli suhteellisen yksinkertainen kemiallinen yhdiste, jota esiintyy kuningatarhyytelössä ja joka pysäyttää HDAC-entsyymien toiminnan, jotka normaalisti poistavat asetyylilappuja histoneista. Tämä johtaa asetyylilappujen kertymiseen mehiläisen alkioiden soluihin, ja kuten aiemmin kuvattu DNA-metyyliryhmien väheneminen, Tämän arvellaan käynnistävän kuningattaren kehittämiseen tarvittavat keskeiset geenit. Ilman KUNINGATARHYYTELÖN HDAC-inhibiittoria toukat noudattavat ”oletus” geneettisiä ohjeita ja kehittyvät työläisiksi.
HDAC-estäjät eivät ole tärkeitä vain mehiläiskuningattarille, vaan ne ovat myös osa pientä mutta kasvavaa määrää lääketieteellisesti hyödyllisiä lääkkeitä, jotka kohdistuvat epigeneettisiin tunnisteisiin ja joista on hyötyä joidenkin syöpälajien hoidossa. Lisäksi HDACs: lla on rooli myös aivojemme muistojen muodostamisessa, ja uusilla histoniasetylaatioon vaikuttavilla lääkkeillä voi olla tulevaisuudessa rooli iäkkäiden potilaiden muistihäiriöiden hoidossa.
ympäristö ja epigenetiikka
olemme nähneet, miten kuningattaren ja työläismehiläisen ero määräytyy altistumalla kemikaalille, joka muuttaa suoraan epigeneettisiä tunnisteita, kuten asetyyliryhmiä; mutta onko olemassa esimerkkejä, joissa ravitsemus tai muut ympäristön näkökohdat vaikuttavat ihmispopulaatioihin tavalla, joka voidaan selittää epigenetiikalla? Emme tietenkään voi tehdä kokeita ihmispopulaatioilla kuten mikroskooppisilla matoilla tai mehiläisillä, mutta joskus ihmiskunnan historia tai luonnonilmiöt tekevät sen puolestamme. Yksi tällainen esimerkki on niin sanottu Hollannin Nälkätalvi. Toisen maailmansodan viimeisenä vuonna Euroopassa Saksan miehitysjoukkojen Alankomaiden siviiliväestölle määräämä elintarvikesaarto johti ankaraan nälänhätään, joka sattui samaan aikaan erityisen ankaran talven kanssa. Noin 20 000 ihmistä kuoli nälkään, kun ruoka-annokset putosivat alle 1 000 kilokaloriin päivässä. Sodan kaaoksesta huolimatta Terveydenhuolto ja asiakirjat säilyivät koskemattomina, minkä ansiosta tiedemiehet pystyivät myöhemmin tutkimaan nälänhädän vaikutusta ihmisten terveyteen. He havaitsivat, että lapsilla, jotka olivat kohdussa nälänhädän aikana, oli elinikäinen suurempi mahdollisuus sairastua erilaisiin terveysongelmiin verrattuna nälänhädän jälkeen siitettyihin lapsiin. Herkin ajanjakso tälle vaikutukselle oli raskauden ensimmäiset kuukaudet. Kohdussa näyttää siis tapahtuvan kehityksen alkuvaiheessa jotain, joka voi vaikuttaa yksilöön koko loppuelämän ajan.
epigeneettiset vaikutukset voivat joskus siirtyä lapsenlapsiin
vieläkin yllättävämpää on, että joidenkin tietojen mukaan nälkätalven aikana raskaana olleiden naisten lapsenlapset kokevat joitakin näistä vaikutuksista. Siitä, mitä olemme jo keskustelleet, tämä viittaa vahvasti epigeneettiseen mekanismiin. Itse asiassa, tutkimus Hollannin Nälkätalvi perheiden jatkuu, ja äskettäin tutkimus tarkastelemalla geeni galled IGF2 löytyi alhaisempi metyyli tag DNA tämän geenin yksilöiden altistui nälänhädälle ennen syntymää. Vaikka IGF2 ei itse ole osallisena näiden ihmisten lisääntyneeseen heikon terveyden riskiin, se osoittaa, että epigeneettiset vaikutukset (eli metyylilappujen määrän vähentäminen tietyissä geeneissä), jotka tuotetaan ennen syntymää, voivat kestää useita vuosikymmeniä. Eläinkokeissa on myös havaittu, että emon ruokavaliolla voi olla vaikutuksia jälkeläisiinsä. Esimerkiksi lampaiden ruokkiminen ruokavaliolla, josta puuttuu metyyliryhmien valmistamiseen tarvittava ravinto, johtaa jälkeläisiin, joiden DNA: n metylaatiomallit ovat muuttuneet ja joilla on odotettua enemmän tiettyjä terveysongelmia.
epigenetiikka ja jälki, miksi äidin ja isän geenit eivät aina vastaa
meillä kaikilla on soluissamme 23 kromosomiparia. Jokaisesta parista yksi tuli äidiltä ja yksi isältä. Näin perimme yhden kopion jokaisesta geenistä kummaltakin vanhemmalta ja yleensä oletamme, että geenin toiminta ei riipu siitä, kummalta vanhemmalta se on peräisin. Leimattujen geenien kohdalla asiat ovat kuitenkin toisin. Näissä geeneissä joko äidin tai isän kopio geeni on aktiivinen, kun taas toinen pidetään hiljaa. Ihmisillä ja hiirillä on ainakin 80 painautunutta geeniä, joista monet osallistuvat alkion tai istukan kasvuun. Miten yksi kopio geenistä voidaan kytkeä pois päältä, kun taas toinen kopio samassa solussa kytketään päälle? Vastaus on epigenetiikka. Luultavasti tutkituin painettu geeni on IGF2 (KS.yllä). IGF2: n yksi osa toimii kytkimenä. Jos DNA metyloidaan tässä, voidaan ilmaista IGF2-geeni. Kytkin on vain metyloitu Isän kopio geenin ja niin vain tämä kopio ilmaistaan, kun taas äidin kopio on hiljainen. Tämän kytkimen uskotaan olevan asetettu sukusoluihin (munasoluihin ja siittiöihin), joten alusta alkaen äidiltä ja isältä saadut geenit merkitään eri tavoin epigeneettisillä tunnisteilla, joten ne eivät ole vastaavia.
leimautuminen ja mielenterveyshäiriöt
Angelmannin ja Prader-Willin oireyhtymät ovat kaksi erillistä geneettistä tilaa, joilla on erilaiset oireet, jotka molemmat johtuvat kromosomin 15 osan menetyksestä. Lapset, jotka perivät yhden kopion tästä viallisesta kromosomista, kehittävät joko Angelmannin tai Prader-Willin oireyhtymän, vaikka heillä on normaali kopio kromosomista toiselta vanhemmaltaan. Miten sitten sama mutaatio (kromosomin 15 osan menetys) johtaa näihin kahteen eri tilaan? Vastaus on löytö, että tämä tietty osa kromosomi 15 sisältää useita geenejä, jotka on painettu, joten vain isän tai äidin kopio näistä geenin ilmaistaan; kumpi näistä kahdesta oireyhtymät esiintyy riippuu siitä, onko deleetio oli äidin vai isällisesti periytyvä kromosomi. Kun viallinen kromosomi periytyy isältä, ei ole olemassa toimivaa kopiota emon kromosomi 15: stä pois kytketyistä geeneistä ja tuloksena on Angelmannin oireyhtymä ja päinvastoin Prader-Willin oireyhtymä. Tämä on aivan toisin kuin useimmat geneettiset tilat, kuten kystinen fibroosi, jossa vaikutus kehitykseen tai terveyteen nähdään vain, kun mutatoitunut geeni tai geenit on peritty molemmilta vanhemmilta.
pojat vastaan Tytöt, miten koko kromosomi kytketään pois
osa genetiikasta, josta useimmat meistä tietävät, tekee pojasta pojan ja tytöstä tytön. X-ja Y-kromosomit. Aivan olemassaolomme alussa jokainen meistä sai yhden X-kromosomin äidiltään munasolun kautta, ja siinä missä tytöt saivat toisen X-kromosomin isiltään, sperman kautta pojat saivat Y-kromosomin. Urosalkion soluissa oleva Y-kromosomi ohjaa sen kehittymään pojaksi, kun taas kahdella X-kromosomilla ja ilman Y-kromosomia naarasalkio kehittyy tytöksi. Saatat huomata, että tässä on epätasapaino. Meillä kaikilla on kaksi jokaista muuta kromosomia, mutta sukupuolikromosomeissa (X ja Y) tytöillä on kaksi X: ää, kun taas pojilla on vain yksi X (ja Y). Vaikka Y-kromosomi sisältää vain vähän geenejä, jotka liittyvät lähinnä ”malenessiin”, X-kromosomi sisältää melko vähän geenejä, jotka osallistuvat tärkeisiin prosesseihin, kuten värinäköön, veren hyytymiseen ja lihasten toimintaan. Jotta X-kromosomigeenien ”annostus” mies-ja naissolujen välillä tasaantuisi, yksi kokonainen X-kromosomi kytketään pois päältä naissoluissa. Tätä kutsutaan X-kromosomin inaktivaatioksi ja se tapahtuu hyvin varhaisessa kohdussa. Tässä prosessissa solut sammuttavat satunnaisesti joko isän tai äidin X-kromosomin, niin että kun tyttövauva syntyy, hänen ruumiinsa on solujen sekoitus tai Kimera, jossa joko äidin tai isän X-kromosomi on kytketty pois päältä. Tapa, että tämä tapahtuu liittyy tyyppi epigeneettisiä tunnisteet, että olemme keskustelleet ja se on ollut tiedossa vuosikymmeniä, että naisten solut sisältävät yksi erittäin kompakti X-kromosomi kutsutaan Barr elin, joka voidaan nähdä mikroskoopilla, ja tämä on inaktiivinen X-kromosomi.
kilpikonnakissan tapaus
meille kaikille lienee tuttua kilpikonnakissat ja niiden kirjava turkki, jossa on laikkuja oranssista ja mustasta turkista. Mitä et ehkä tiedä, että lähes kaikki kissat, joilla on tällainen Turkki, ovat naisia! Syynä tähän on se, että kissan X-kromosomissa sijaitsee turkin värin geeni. Tästä geenistä on kaksi versiota, nimeltään ”O” ja ”o”; toinen antaa inkiväärin Turkin ja toinen mustan. Kaksi kopiota samasta versiosta naaraskissalla johtaa vastaavasti inkivääriin tai mustaan Turkkiin, mutta yksi kopio kummastakin antaa tortoiseshell-efektin. Tämä johtuu X-kromosomin inaktivaatiosta. Näiden kissojen iho koostuu solulaastareista, joissa joko emon tai isän X-kromosomi on inaktivoitunut. Tämä johtaa ihon O-geenin kytkeytymiseen päälle ja O-geenin hiljentymiseen joissakin laikuissa (oranssi turkki) ja o-geenin hiljentymiseen muissa laikuissa (musta Turkki), mistä johtuu kilpikonnankuoren kuvio. Koska uroskissoilla on vain yksi X-kromosomi eikä X-kromosomin inaktivaatiota, ne ovat kauttaaltaan joko oransseja tai mustia.
epigeneettinen periytyminen, voivatko epigeneettiset tilat siirtyä sukupolvelta toiselle?
kuten sukkulamadon esimerkistä on käynyt ilmi, epigeneettiset vaikutukset (tässä tapauksessa pidentynyt elinikä) voivat joskus siirtyä sukupolvelta toiselle, vaikka vaikutukset näyttävät kestävän vain muutaman sukupolven ajan. Onko esimerkkejä, joissa epigeneettiset vaikutukset siirtyvät myöhempiin sukupolviin ihmisissä tai muissa nisäkkäissä? On jonkin verran näyttöä siitä, että Hollannin nälkätalven vaikutukset vaikuttivat nälänhädän aikana raskaana olleiden naisten lapsenlapsiin. Samoin tutkimuksessa 1800-luvun pohjoisruotsalaisesta väestöstä, joka kärsi nälänhädästä ja runsaudesta, saatavilla olevan ravinnon määrä näyttää vaikuttaneen seuraavan sukupolven terveyteen ja pitkäikäisyyteen.
hiiren Hiusten väri voidaan määrittää epigeneettisen vaikutuksen avulla
ehkä tunnetuin esimerkki sukupolvelta toiselle ulottuvista epigeneettisistä vaikutuksista on hiiren Agouti-geeni. Tämä geeni säätelee hiusten väriä, ja se kytkeytyy päälle juuri oikeaan aikaan karvatuppisoluissa, jolloin muuten tummiin karvoihin syntyy keltainen raita, jolloin tuloksena on niin sanottu agouti-Turkki. Mutta hiirillä, joilla on tietty agouti-geenin muunnos nimeltä Avy, on karvapeite, joka on missä tahansa villin tyypin hiirten keltaisen ja normaalin tumman (agouti) kuvion välillä. Keltahiiret myös lihovat ja kärsivät muista terveysongelmista. Avy-geenillä näyttää siis olevan vaihteleva vaikutus (itse asiassa Avy tarkoittaa Avariable yellow). Miten tämä toimii on ihmetyttänyt geneetikot vuosia, mutta voimme nyt tunnistaa tämän epigeneettinen vaikutus. Keltainen Turkki johtuu siitä, että Agouti-geenin Avy-versiossa on Virheelliset kontrollit ja se on päällä koko ajan. Virheelliseen kontrolli-DNA-sekvenssiin lisätään kuitenkin usein metyylilappuja, ja tämä pyrkii kytkemään geenin pois päältä, jolloin yksittäisillä hiirillä esiintyy kirjavaa tai tummaa agouti-turkista. Avy-geenin omaaville emoille syntyneet poikaset ovat väriltään keltaisesta tummaan, mutta osuus riippuu emon turkin väristä; tummien (agouti) naaraiden poikueissa on todennäköisemmin tummia poikasia. Lisäksi tummien jälkeläisten osuus on suurempi, jos sekä emolla että isoäidillä on tumma väritys. Niinpä agouti-väri, joka määritetään epigeneettisesti (Avy-geenin metyylilappujen lukumäärän perusteella), voi jossain määrin siirtyä sukupolvelta toiselle.
munasoluilla ja siittiöillä ei yleensä ole epigeneettisiä vaikutuksia
vaikka löytyy tapauksia, joissa epigeneettiset vaikutukset ilmeisesti kestävät vanhemmilta jälkeläisille, näin ei yleensä ole ja lähes kaikki epigeneettiset Kytkimet tai merkit nollautuvat sukusoluissa (munasoluissa ja siittiöissä) ja alkion varhaisimmissa kehitysvaiheissa. Itse asiassa jos näin ei olisi, hedelmöittyneen munan hämmästyttävä kehitys täysin muodostuneeksi olennoksi olisi mahdotonta.
siirryttäessä hedelmöittyneestä munasolusta täysin muodostuneeseen ihmiseen kaikki on (epi) genomissa
tähän mennessä olemme kuvanneet joitakin epigeneettisen säätelyn erityistapauksia, mutta nyt tiedämme, että epigenetiikka sen laajassa merkityksessä (miten geenejä ilmaistaan ja käytetään, eikä geenien DNA-sekvenssi) on keskeistä siinä, miten hedelmöittynyt munasolu voi lopulta synnyttää kokonaisen organismin ja miten solut, sanotaanko ihosi, pysyvät ihosoluina ja eroavat aivosoluistasi, vaikka ne sisältävät täsmälleen samat geenit. Pian hedelmöityksen jälkeen kehittyvä ihmisalkio koostuu solupallosta, jota kutsutaan alkion kantasoluiksi. Jokainen näistä soluista pystyy synnyttämään mitä tahansa solutyyppiä elimistössä alkion kasvaessa (esimerkiksi aivosoluja, ihosoluja tai verisoluja). Sitä vastoin 9 kuukautta myöhemmin, kun vauva on syntynyt, suurin osa hänen ruumiinsa soluista on sitoutunut olemaan tietyntyyppinen solu, jolla on tiettyjä toimintoja. Solujen jakautuessa alkioiden kantasolupallo kehittyy vähitellen kaikkiin vauvan solutyyppeihin ja rakenteisiin. Jotta tämä tapahtuisi, tuhansien geenien on kytkeydyttävä päälle tai pois päältä juuri oikeaan aikaan ja oikeissa soluissa alkion kasvaessa. Esimerkiksi geenit, jotka tekevät kuituisesta keratiiniproteiinista, joka antaa ihollemme sen voiman, kytkeytyvät päälle vain ihosoluissa eikä kehittyvissä aivoissa, ja geenit, joita tarvitaan, jotta aivosolut kehittyisivät ja muodostaisivat yhteytensä, ovat aivoissa, mutta eivät ihossa.
kehityksen aikana geenit on kytkettävä päälle ja pois päältä. Epigeneettiset tunnisteet auttavat tässä
erittäin suuri tutkimusalue koskee nykyään sitä, miten kaikki tämä geenin kytkeminen pois päältä toimii, ja suuri osa tästä prosessista käyttää epigeneettisiä kemiallisia tunnisteita, erityisesti asetyyli-ja metyylihistoni-tunnisteita. Jotta nämä alkion kantasolut voisivat synnyttää kaikki muut solutyypit, niiden epigeneettiset Kytkimet nollautuvat (lähes) täysin aikuisten soluihin verrattuna. Olen laittanut” melkein ” suluissa, koska tiedämme painettujen geenien ja transgenerationaalisen epigeneettisen periytymisen perusteella, että poikkeuksia on.
epigenetiikka, Dolly-lammas ja ystävät
helmikuussa 1997 Dolly-nimisestä lampaasta tuli lajinsa kuuluisin esikuva, lyhyesti jopa TV-julkkis. Syynä hänen maineeseensa on se, että hän oli ensimmäinen nisäkäs, joka ”luotiin” somaattisten solujen tuman siirroksi kutsutulla prosessilla, eli toisin sanoen ensimmäinen ihmisen tekemä klooni (ihmisen tekemä erotukseksi identtisistä kaksosista, jotka ovat luonnollisia klooneja). Hänen syntymäänsä johtanut prosessi vaati kypsän munasolun (hedelmöittymättömän munasolun) yhdeltä naaraslampaalta ja tavallisen solun toisen lampaan utareesta. Ensin munasolusta poistettiin Tuma (DNA: ta sisältävä osa). Tämä tehtiin käyttämällä erityistä mikroskooppia, koska vaikka varhaismunasolut ovat melko suuria verrattuna muihin soluihin, ne ovat silti liian pieniä nähdä paljain silmin. Sitten utaresolun Tuma työnnettiin enukleoituneeseen munasoluun. Niinpä Dollylla oli kolme ”emoa”: munasolun luovuttaja, utaresolun luovuttaja ja kehittyvän alkion synnyttänyt lammas. Isää ei ollut mukana. Vaikka tämä prosessi oli ja on edelleen hyvin tehoton, se oli ensimmäinen todiste siitä, että aikuisen nisäkässolun geenit voidaan ”epigeneettisesti uudelleenohjelmoida” takaisin alkion kantasolujen tilaan, josta voi kehittyä mitä tahansa muunlaista solua. Myöhemmin samaa menetelmää on sovellettu muihin lajeihin, ja sillä voi olla lääketieteellistä käyttöä sellaisten solujen tuottamisessa, jotka voisivat korjata vamman tai sairauden vaurioittamia kudoksia.
Yhteenveto: epigenomi ja ENCODE-projekti-biologian” Large Hadron Collider ”
kun taas termi ”genomi” viittaa organismin koko DNA-sekvenssiin (kolme miljardia kirjainta siitä ihmisille), epigenomi viittaa epigeneettisten muutosten koko kuvioon kaikissa geeneissä, mukaan lukien metyyli-DNA-tunnisteet, metyylihistoni-tunnisteet, asetyylihistoni-tunnisteet ja muut kemialliset tunnisteet, joita emme ole maininneet, kussakin solutyypissä organismin. Tämä edustaa lähes käsittämätöntä määrää tietoa, joka tekee mitättömäksi jopa ihmisen genomiprojektin. Epigenomin tuntemus on kuitenkin välttämätöntä, jotta voidaan täysin vastata joihinkin biologian suurimpiin kysymyksiin, kuten: miten kehitymme identtisten solujen muodostamasta pallosta kokonaiseksi organismiksi? miksi vanhenemme? entä miten voimme ymmärtää paremmin syövän kaltaisia sairauksia? Ei ole yllättävää, että epigenetiikka ja epigenomi on suuri tutkimusalue. Osa tämän alan tutkimuksesta sisältyy ENCODE (Encyclopedia of DNA Elements) – projektiin, joka on käynnissä oleva hanke, jossa selvitetään epigeneettisten tagien kuvioita monissa eri solutyypeissä ihmisen koko genomin osalta (http://genome.ucsc.edu/ENCODE/). KOODAUSPROJEKTIA on joskus verrattu Sveitsin Large Hadron Collideriin tai LHC: hen. LHC on suurin koskaan rakennettu tieteellisten laitteiden ja kokeiden fyysikko suorittaa sen tavoitteena tutkia perustavanlaatuisia yksityiskohtia aineen, joka muodostaa meidän maailmankaikkeus. Vaikka biologit eivät ole (tai tarvitsevat) niin näyttäviä pala pakki tutkimuksensa, vaivaa tutkia koukeroisuus ihmisen epigenome on verrattu LHC projekti, koska sen laajuus, monimutkaisuus ja määrä tietoa luodaan.
epigeneettiset virheet
epigenetiikka on alue, jossa tieteellinen tietämyksemme kasvaa nopeasti. Tutkijat ovat havainneet muun muassa sen, että epigeneettiset virheet ovat yleisiä syövän kaltaisissa sairauksissa ja ikääntyvissä soluissa. Tämän seurauksena tutkijat kehittävät lääkkeitä, jotka kohdistuvat viallisiin epigenomeihin ja yksi ensimmäisistä esimerkeistä on HDAC-estäjien käyttö, joka on samanlainen kuin kuningatarhyytelössä oleva yhdiste. Tutkittaessa outoja perintökuvioita, kuten geneettistä leimautumista, keltainen/agouti Avy-hiiri, kaikki naaraskilpikonnakissapopulaatio ja muut siihen liittyvät ilmiöt biologit ovat paljastaneet kokonaan uuden informaatiokerroksen, joka sijaitsee geeniemme DNA-sekvenssin ”päällä”. Nämä uudet löydöt selittävät näitä aiempia hämmentäviä havaintoja, mutta niillä on myös suuri potentiaali ihmisten sairauksien uuteen ymmärtämiseen ja hoitoihin.
Jatkoluku:
- lintu, Adrian. Epigenetiikka. Instant Expert No. 29′, New Scientist, 5th January 2013, No. 2898.
- Carey, Nessa. ”The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance”. Kustantaja: Icon Books. Paperback 1. maaliskuuta 2012. ISBN-10: 1848313470. RRP Hinta £9-99.
epigeneettiset vaikutteet ja taudit verkkosivulla:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply