CIMAvax-EGF: Uusi terapeuttinen rokote pitkälle edenneeseen keuhkosyöpään
raportti
CIMAvax-EGF: Uusi terapeuttinen rokote pitkälle edenneeseen keuhkosyöpään
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia neninger2
1center of molecular Immunology, cimave. 216 corner 15, Atabey, Playa, POBox 16 040, Havana, Kuuba
2hermanos Ameijeiras HospitalSan Lázaro # 701 E / Belascoín y Marqués González, Centro Habana, Havana City, Kuuba.
Abstrakti
tulokset, joiden perusteella Kuuban sääntelyvirasto (CECMED) voi myöntää Terveysrekisteröinnin cimavax-EGF: n syöpärokotteelle pitkälle edennyttä ei-pienisoluista keuhkosyöpää (NSCLC) varten, on esitetty. Kyseessä oli terapeuttisen rokotteen ensirekisteröinti Kuubassa ja myös keuhkosyöpärokotteen ensirekisteröinti koko maailmassa. Siksi keuhkosyöpäpotilaille tarjotaan ainutlaatuista terapeuttista rokotetta, joka parantaa selviytymistä ja heidän elämänlaatuaan. Tätä varten oli kohdattava merkittäviä prekliinisiä, kliinisiä, sääntelyyn liittyviä, tuotannollisia ja neuvotteluhaasteita. Näillä aloilla saadut tulokset johtivat 18 tieteelliseen artikkeliin, jotka julkaistiin korkean vaikutuksen lehdissä ja 4 keksintökohdetta, jotka tuottivat useita patentteja Kuubassa ja muissa maissa. Prekliinisessä ympäristössä immunogeenisuus -, turvallisuus-ja tuumorivaikutukset osoitettiin eri eläinlajeilla. Kliininen kokemus alkoi vuonna 1995. Tähän mennessä Kuubassa on saatu päätökseen viisi vaiheen I-II kliinistä tutkimusta, kaksi vaiheen II tutkimusta, yksi Kuubassa ja toinen Kanadassa ja Yhdistyneessä kuningaskunnassa, ja Kuubassa on parhaillaan käynnissä vaiheen II-III tutkimus, jonka aikataulu on optimoitu, sekä vaiheen III tutkimus. Sääntelyalalla suunniteltiin ja toteutettiin nopeutettu rekisteröintistrategia. Tämän ainutlaatuisen tuotteen kehittäminen edellytti uusia sääntelykäsityksiä. Toteutettiin skaalautuva, toistettava ja hallittu tuotantoprosessi sekä laatujärjestelmä, joka varmisti hyvän tuotantotavan täyden noudattamisen. Rahoitus tuotekehitykseen tuli uuden neuvottelustrategian eli aineettomien hyödykkeiden neuvottelemisen toteuttamisesta.
avainsanat: syöpärokote, NSCLC, Fast-Track-rekisteröinti, CIMAVAX-EGF, vaiheen II-III kliininen tutkimus
johdanto
epidermaalisen Kasvutekijäreseptorin (EGFR) muodostaman järjestelmän ja sen ligandien välinen suhde syövän kehittymiseen on hyvin tunnettu. Epidermoidisissa alkuperäkasvaimissa EGFR: n yliekspressio liittyy huonoihin ennusteisiin ja varhaisiin pahenemisvaiheisiin leikkauksen jälkeen. Siksi tämä järjestelmä on tullut tärkeä tavoite anti-kasvain hoitoja.
solujen proliferaatiomekanismit käynnistetään EGF: n sitoutuessa EGFR: ään. Terapeuttinen lähestymistapamme koostuu rokotteesta, jonka EGF-formulaatio tekee siitä immunogeenisen ja saa aikaan humoraalisen immuunivasteen. Spesifisten EGF-vasta-aineiden tuotanto, jotka sitoutuvat autologiseen EGF: ään, estää EGF: ää sitoutumasta EGFR: ään, mikä käynnistää kyseisestä yhteisvaikutuksesta johdetut solujen proliferaatiomekanismit (1-4).
Tässä kerrotaan tulokset tämän rokotteen (CIMAvax-EGF) rekisteröinnistä Kuubassa. Tämä oli osa maailmanlaajuista strategiaa, joka sisältää uusia kliinisiä, sääntelyyn liittyviä sekä teknologisia ja liiketoiminnallisia panostuksia, ja sitä tukee 18 kansainvälistä tieteellistä julkaisua ja immateriaalioikeuksia maailmanlaajuisesti. Kuvaamme myös eri alojen innovaatioita, jotka mahdollistivat Cimavax-EGF: n rekisteröinnin Kuubassa ja Perussa.
tulokset ja keskustelu
EGF-rokotus on turvallinen, immunogeeninen ja parantaa eloonjäämistä ja parantaa elämänlaatua potilailla, joilla on pitkälle edennyt keuhkosyöpä
kliininen kokemus cimavax-EGF: stä ei-pienisoluisen keuhkosyövän (NSCLC) hoidossa pitkälle edenneessä vaiheessa alkoi vuonna 1995. Tähän mennessä Kuubassa on saatettu päätökseen viisi vaiheen I-II kliinistä tutkimusta; kaksi satunnaistettua vaiheen II kliinistä tutkimusta, yksi Kuubassa ja toinen Kanadassa ja Yhdistyneessä kuningaskunnassa, ja Kuubassa on meneillään vaiheen III tutkimus. Yli 800 pitkälle edennyttä syöpäpotilasta on saanut cimavax–EGF: ää, mikä osoittaa, että se on turvallinen, immunogeeninen ja voi parantaa eloonjäämistä hyvällä elämänlaadulla.
faasin I-II tutkimusten päätavoitteena oli valita paras rokotemuoto (kantajaproteiini ja adjuvantti), annos ja hoito-ohjelma. Tulokset osoittivat p64k-proteiinin edut kantajaproteiinina ja montanidi ISA51: n edut adjuvanttina. Annoksen suurentamisen lisääntynyt immunogeenisuus osoitettiin myös (5-7).
kaikkien faasin I-II tutkimusten yhdistettyjen tietojen analyysi osoitti eloonjäämisen parantuneen merkittävästi potilailla, joilla oli parempi vasta-ainevaste tai hyvä vasta-ainevaste (GAR), ja potilailla, joilla rokottamisesta johtuva EGF-seerumin pitoisuuksien () selvempi lasku. Kaikkien rokotettujen potilaiden eloonjäämisen osoitettiin myös parantuneen merkittävästi verrattuna aikaisempaan vertailuryhmään (7).
faasin II kliininen tutkimus tehtiin 80 potilaalla, jotka satunnaistettiin saamaan CIMAvax-EGF: ää ja parasta tukihoitoa (BSC) (40 potilasta) tai pelkkää BSC: tä (40 potilasta) sen jälkeen, kun ensimmäisen hoitolinjan kemoterapia oli saatu päätökseen. Aiemmat havainnot vahvistuivat tässä oikeudenkäynnissä. Noin 50% rokotetuista potilaista oli GAR-potilaita, ja he selviytyivät merkittävästi enemmän kuin potilaat, jotka eivät saavuttaneet GAR-luokitusta (jotka luokiteltiin huonoiksi vasta-ainevasteen saajiksi, PAR). Vastaavasti potilaat, joilla in vivo väheni eniten, selvisivät hengissä huomattavasti enemmän kuin potilaat, joilla tätä laskua ei havaittu (Taulukko 1). EGF-vasta-ainetittereiden välillä havaittiin merkittävä käänteinen korrelaatio , jota esiintyi rokotetuilla potilailla mutta ei kontrolleilla, mikä osoittaa, että se johtui rokotuksesta (Kuva 1).
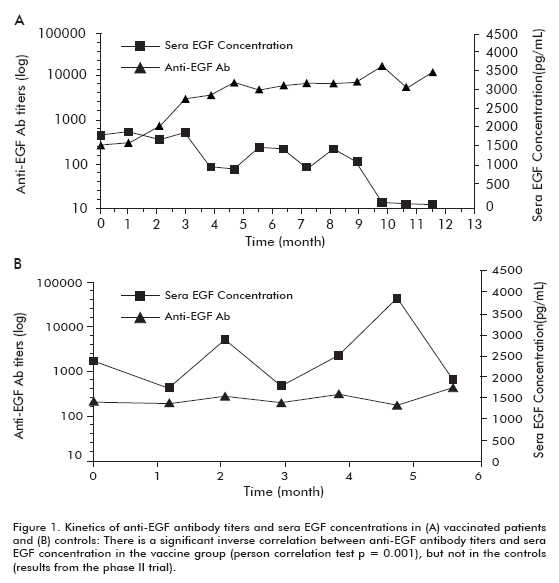
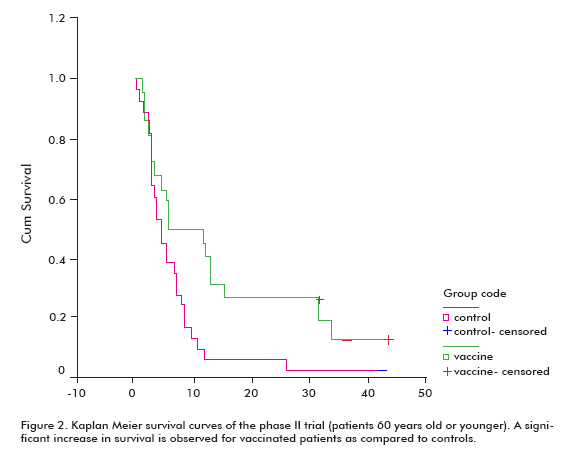
kaikilla rokotetuilla potilailla oli lisääntynyt eloonjäämiskehitys (18, 53 ± 11, 47; keskiarvo ± mediaani) verrattuna rokottamattomiin verrokkiin (7, 55 ± 5.33), joka oli merkittävä 60-vuotiaiden tai sitä nuorempien potilaiden ryhmässä (Log rank-testi; p < 0, 05) (kuva 2) (8).
kuten in vitro-kilpailutestissä osoitettiin, rokotettujen potilaiden Seerumit estivät EGF: n sitoutumisen EGFR: ään. Tämä sitoutumisen esto oli verrannollinen vasta-ainetittereihin ja eloonjäämiseen. Lisäksi rokotettujen potilaiden Seerumit estivät EGFR-fosforylaatiota suhteessa EGF-vasta-ainetittereihin.
EGF / EGFR-sitoutumiskohdan (EGF-molekyylin silmukka B) etuoikeutettua tunnistamista tutkittiin. Potilaat, joiden seerumi ensisijaisesti tunnistaa loop B: n, selviytyivät huomattavasti enemmän kuin potilaat, jotka eivät tunnistaneet tätä epitooppia (9).
Kuubassa saatiin äskettäin päätökseen annoksen / aikataulun optimointikoe (Vaihe I-II). Sen suunnittelussa otettiin huomioon kaikki aiemmissa tutkimuksissa immunogeenisuutta lisäävät tekijät, joihin kuuluivat: Montanide ISA51: n adjuvanttina suurennettu annos, neljä injektiokohtaa ja kahden rokoteannoksen antaminen ennen ensilinjan solunsalpaajahoitoa ja sen jälkeen rokotus. Tämän tutkimuksen tulokset osoittivat, että immunogeenisuus lisääntyi merkittävästi, ja 95% GAR: sta saavutti kymmenkertaisen määrän aiempia maksimaalisia vasta-ainetittereitä. Kaikki rokotetut pa-tientit selvisivät faasin II tutkimuksesta (10) huomattavasti enemmän kuin kontrollit.
potilaiden seerumeilla havaittiin myös suurentunut kyky estää EGF / EGFR: n sitoutumista ja EGFR: n fosforylaatiota. Seitsemännessä kuussa solunsalpaajahoidon päätyttyä vasta-ainevaste siirtyi kohti EGF-molekyylin luuppia B, mikä voi viitata immuunivasteen laadun paranemiseen. Tämän tutkimuksen tulokset osoittivat, että CIMAvax-EGF-vasteessa on parannuksen marginaali, joka voidaan saavuttaa annosta ja hoito-ohjelmaa muuttamalla (10).
näiden kokeiden tuloksia validoidaan parhaillaan Kuubassa käynnissä olevassa vaiheen III kokeessa.
rokotteen rekisteröintiä koskevan sääntelystrategian suunnittelu ja täytäntöönpano, jotta se olisi kaikkien pitkälle edenneiden ei-pienisoluisten keuhkosyöpäpotilaiden saatavilla
CIMAVAX-EGF on keuhkosyövän hoitoon tarkoitettu terapeuttinen rokote, joka on ainutlaatuinen maailmassa. Laadittiin ja pantiin täytäntöön maailmanlaajuinen strategia, jota ohjasivat viranomaisvaatimukset ja joka koski pikarekisteröintiä Kuubassa. Toimeksiantajan (CIM) ja Kuuban sääntelyviraston (CECMED) läheisellä suhteella pyrittiin määrittämään tuotteen saamista ja sen nopeaa soveltamista koskevat vaatimukset pitkälle edenneiden syöpäpotilaiden hyväksi ilman muita terapeuttisia vaihtoehtoja. Strategiaan kuului laatujärjestelmän suunnittelu, laadunvalvonta ja tekniset tiedot sekä tuotekehityksen eri vaiheet kattavat GMP-vaatimukset. Tätä globaalia strategiaa voidaan hyödyntää muiden vastaavien tuotteiden kehittämisessä.
kertynyt kokemus sääntelystä ja dokumentaatio johtivat kliinisten tutkimusten hyväksymiseen eri maissa. Kaikki tiedot sisältävä asiakirja-aineisto mahdollisti CIMAvax-EGR: n rekisteröinnin Kuubassa ja Perussa. Voimme siis todeta, että meillä on eri maissa määritelty huumausaineiden rekisteröintistrategia.
GMP-tuotantoprosessi, jossa syntyy skaalautuva, johdonmukainen ja spesifikaatioiden mukainen tuote
ensimmäinen haaste cimavax-EGF: n tuotantoprosessin suunnittelussa oli immunogeeninen EGR-valmiste. Se saatiin konjugoimalla ihmisen rekombinantti EGF kemiallisesti rekombinanttikalvoproteiiniin P64k (Neisseria meningitidis-bakteerista). Konjugaatti ruiskutetaan yhdessä sopivan adjuvantin kanssa (tällä hetkellä Montanide ISA 51, Seppic, Ranska).
aluksi suunniteltiin laboratoriomittakaavaista prosessia. Myöhemmin suunniteltiin ja toteutettiin skaalautuva (ja skaalautuva) saniteettiprosessi ja toistettavissa oleva prosessi, joka noudattaa GMP-ohjeita. Lisäksi suunniteltiin ja toteutettiin in vitro-ja In vivo-analyyttiset määritykset raaka-aineiden sekä Väli-ja lopputuotteiden laadun arvioimiseksi.
kaikki muutokset arvioitiin ja niitä tuettiin nykyisessä Sääntelystrategiassa. Tulokset vastaavuustutkimuksesta, jossa vertailtiin molempia tuotteita, saivat cecmedin hyväksynnän skaalatulle prosessihakemukselle ja hyväksynnän tässä prosessissa saadulle tuotteelle sen kliiniseen käyttöön. Tuotantoprosessin skaalaus ja optimointi vaihtuivat julkaisuun (11) ja uuteen keksintökohteeseen, jonka patentteja myöhemmin esiteltiin eri maissa.
aineettomien hyödykkeiden neuvottelu myönsi yhdysvaltalaisille varoja projektinkehitykseen ja myös kokemusta yhteistyöstä eri maiden sääntelyviranomaisten kanssa
tästä projektista neuvoteltiin ulkomaisten kumppaneiden kanssa uuden käsitteen ”neuvottelu aineettomista hyödykkeistä” pohjalta, jota tuettiin pääasiassa kehitteillä olevan tuotteemme immateriaalioikeuksien kautta. Neuvottelustrategiaan kuului hankkeen lisensointi sen yhteistä kehittämistä varten muiden maiden kanssa, mikä tarkoittaa, että ulkomaiset vastapuolet kattoivat sääntelytoimien ja kliinisten tutkimusten kustannukset alueellaan. Neuvottelujen tuloksena Kuuba sai maksuja välitavoitteista. Tämä neuvottelutapa mahdollisti myös jatkuvan vaihdon asiantuntijoiden kanssa täällä ja ulkomailla, mikä lisäsi kokemustamme. Myönteisiä tuloksiamme tällä neuvottelutavalla voitaisiin soveltaa myös muihin maassamme käynnissä oleviin tuotteisiin.
tutkimuksen relevanssi
Cimavax-EGF on ensimmäinen Kuubassa rekisteröity terapeuttinen syöpähoitorokote ja maailman ensimmäinen keuhkosyöpähoitorokote. Keuhkosyöpä on ratkaisematon terveysongelma, jossa todetaan vuosittain yli 1,3 miljoonaa tapausta ja sama määrä kuolemia kaikkialla maailmassa. Kuubassa se on molempien sukupuolten tärkein syövän aiheuttama kuolinsyy, ja vuosittain kuolleita on yli 4 000. Edenneessä vaiheessa diagnosoitujen potilaiden ensisijainen hoitomuoto on ensilinjan kemoterapia, jota voidaan antaa samanaikaisesti sädehoidon kanssa. Tämä on palliatiivinen, ei-parantava hoito, täydellinen vaste kemoterapialle on hyvin harvinainen ja objektiivinen vaste (täydellinen tai osittainen) esiintyy vain 25%: lla potilaista.
CIMAvax-EGF tarjoaa vaihtoehtoisen hoidon näille potilaille, jotka ovat jo saaneet ensilinjan solunsalpaajahoitoa. Solunsalpaajahoidon ja/tai sädehoidon vakavat haittatapahtumat ovat hyvin tiedossa, ja ne heikentävät elämänlaatua huomattavasti. Sen sijaan cimavax-EGF-rokotus aiheuttaa vain lieviä tai keskivaikeita eikä vakavia haittavaikutuksia, jotka voidaan ratkaista tavanomaisella elintoimintoja tukevalla hoidolla, samalla kun se parantaa pitkälle edenneiden keuhkosyöpäpotilaiden selviytymistä ja takaa hyvän elämänlaadun.
tähän mennessä yli 800 kuubalaista on saanut cimavax-EGF-hoitoa yli 20 sairaalassa eri puolilla maata. Cimavax-EGR: n rekisteröinti mahdollistaa sen laajentamisen kaikkiin maan potilaisiin, joilla on diagnosoitu pitkälle edennyt keuhkosyöpä.; näin Kuuba on ensimmäinen maa maailmassa, jolla on kansallinen ohjelma, jossa käytetään tätä terapeuttista vaihtoehtoa.
taloudellisten hyötyjen osalta hankkeen neuvottelujen kautta olemme saaneet 6,346 miljoonaa dollaria. Hankkeen neuvottelustrategia on sen yhteinen kehittäminen muiden maiden kanssa, mikä tarkoittaa, että ulkomainen vastine kattaa oman maan kliinisten kokeiden kustannukset, mikä tekee siitä edullisen. Nämä oikeudenkäynnit vaativat miljoonien dollarien investointeja, ja tämä on mahdollista vain, jos ulkomaiset vastapuolet tukevat sitä. Samalla tämä strategia tarjoaa Kuuballe lisää kliinistä tietoa ilman täällä suoritettavista kokeista aiheutuvia kustannuksia. Tähän asti kliinisiä kokeita on tehty Kanadassa, Britanniassa ja Malesiassa. Lähitulevaisuudessa alkavat kliiniset kokeet Kiinassa ja Euroopassa.
osana tätä lisenssistrategiaa ulkomaiset vastapuolet vastaavat myös tuotteiden rekisteröinnistä alueilla, joilla niillä on kaupalliset oikeudet. Rekisteröinti-ja markkinointiprosessien aikana Kuuba saa maksuja välitavoitteista ja myöhemmin myynnin rojalteina.
syöpärokotteiden maailmanmarkkinoita pidetään miljardien dollarien suuruisina. Se, että Kuubassa on ainutlaatuinen tuote pitkälle kehittyneen keuhkosyövän hoitoon, voi tarjota meille vientimahdollisuuksia, jotka voivat rahoittaa tämän tuotteen käytön kansallisessa Terveydenhuoltojärjestelmässämme.
päätelmät
Cimavax-EGF: llä annettu rokotus on turvallinen, immunogeeninen ja johtaa elinajan pidentymiseen ja elämänlaatuun potilailla, joilla on pitkälle edenneitä keuhkokasvaimia. Rokotteen rekisteröintiä koskevan sääntelystrategian suunnittelu ja täytäntöönpano mahdollisti
kaikkien pitkälle edenneiden ei-pienisoluisten keuhkosyöpäpotilaiden käytön Kuubassa. Tätä myönteistä kokemusta voitaisiin soveltaa muihin vastaaviin valmisteilla oleviin tuotteisiin. Laadittiin tuotantoprosessi, joka oli skaalautuva, johdonmukainen ja toistettavissa ja joka noudatti GMP-ohjeita, jotta saatiin tuotettua spesifikaatioiden mukainen tuote. Kokemus aineettomien hyödykkeiden neuvotteluista on ollut erittäin myönteinen, ja se on myöntänyt Yhdysvalloille varoja hankkeiden kehittämiseen ja tukenut samalla eri maiden sääntelyviranomaisten kanssa tehdystä yhteistyöstä saatua oppimiskokemusta.
kiitokset
kirjoittajat haluavat kiittää seuraavia molekyyliimmunologian Keskuksen asiantuntijoita heidän panoksestaan tähän työhön: Rolando Pérez, Loany Calvo, Suhamy Attention, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Cartroman, Sergio Tasting, Ana Veloso, Reinaldo Crow, Yanelda Lopez, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Wood, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Basin, Mayra Santaelena, Joaquin solozabal, Aida Rodriguez, Maria Elena Garcia, Addis Torres, Eric Chong, Carmen Roll, Mauritius Catala, Soraida Acosta, Barbara Wilkinson, Olga Torres, Normando Iznaga kaikki ne keskus molekyyli-immunologian, ja myös Daniel González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén, Vivian Pujol, Dinorah Torres geenitekniikan ja biotekniikan keskuksesta.
1. González G, Montero E, León K, Cohen IR, Lage A. Autoimmunization to Epidermal Growth Factor, a component of the im-munological homunculus. Autoimmun Rev 2002; 1: 89-95.
2. Lage A, Crombet T, González G. Targeting epidermal growth factor receptor signalling: early results and future trends in oncology. Ann Med 2003; 5(35): 327-36.
3. González G: n ja Lage A: n Syöpärokotteet Hormoniimmuniteetin puutteeseen: The EGF Vaccine Approach: Leading Topics in Cancer Research, Chapter 11, Ed Nova Publishers, 2007.
4. González G ja Lage A. Cancer vaccines for hormone/growth factor immune deprivation: a possible approach for cancer treatment. Curr Cancer Drug Targets 2007; 7: 229-41.
5. González G, Crombet T, Torres F, Catala M, Alfonso L, Osorio m, et al. Epidermaalinen Kasvutekijäpohjainen syöpärokote ei-pienisoluisen keuhkosyövän hoitoon. Ann Onkol 2003; 14: 461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Ei-pienisoluista keuhkosyöpää sairastavien potilaiden hoito EGF – pohjaisella syöpärokotteella. Raportti vaiheen I kokeesta. Cancer Biol Ther 2006; 5(2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. Therapeutic vaccination with epidermal growth factor (EGF) in advanced lung cancer: analysis of pooled data from three clinical trials. Hum Vaccines 2007; 3(1): 8-13.
8. Neninger E, De la Torre A, Osorio M, Catald M, Bravo I, Mendoza m, et al. Vaiheen II satunnaistettu kontrolloitu tutkimus epidermaalisen kasvutekijän rokotteella pitkälle edenneessä ei-pienisoluisessa keuhkosyövässä. J Clin Onkol 2008; 26: 1452-8.
9. García B, Neninger E, De la Torre A, Leonard I, Martínez R, Viada C, et al. Epidermaalisen kasvutekijän vasta-aineet estävät tehokkaasti epidermaalisen kasvutekijän/epidermaalisen kasvutekijän reseptorin sitoutumisen epidermaalisen kasvutekijän vasta-aineisiin, mikä parantaa epidermaalisen kasvutekijän rokotteella hoidettujen pitkälle edenneiden ei-pienisoluisten keuhkosyöpäpotilaiden eloonjäämistä. Clin Cancer Res 2008; 14(3):840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda s, Leonard I, et al. EGF-pohjaisen syöpärokotteen yhdistäminen kemoterapiaan pitkälle edenneessä ei-pienisoluisessa keuhkosyövässä. J Immunother 2009;32: 92-9.
11. A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A, A. Valmistusprosessi epidermaalisen kasvutekijäperusteisen syöpärokotteen kehittämiseksi. Bio-pharm Int, Vaccines Suppl, lokakuu 2008.
Leave a Reply