biologia Majoreille I
oppimistulokset
- yksilöivät yksinkertaisten kemiallisten reaktioiden komponentit
kaikki alkuaineet ovat stabiileimpia, kun niiden uloin kuori on oktettisäännön mukaan täynnä elektroneja. Tämä johtuu siitä, että on energeettisesti suotuisaa atomeille olla tuossa kokoonpanossa ja se tekee niistä vakaita. Koska kaikilla alkuaineilla ei kuitenkaan ole tarpeeksi elektroneja täyttämään uloimpia kuoriaan, atomit muodostavat kemiallisia sidoksia muiden atomien kanssa ja saavat siten tarvitsemansa elektronit vakaan elektronikonfiguraation saavuttamiseksi. Kun kaksi tai useampi atomi sitoutuu kemiallisesti toisiinsa, syntyy kemiallinen rakenne molekyyli. Tuttu vesimolekyyli, H2O, koostuu kahdesta vetyatomista ja yhdestä happiatomista; nämä sitoutuvat toisiinsa muodostaen vettä, kuten kuvassa 1 esitetään. Atomit voivat muodostaa molekyylejä lahjoittamalla, hyväksymällä tai jakamalla elektroneja uloimpien kuoriensa täyttämiseksi.
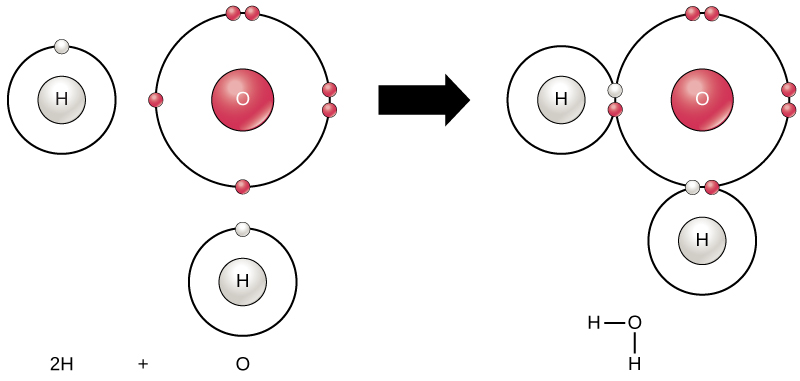
kuva 1. Kaksi tai useampi atomi voi sitoutua toisiinsa muodostaen molekyylin. Kun kaksi vetyä ja happi jakavat elektroneja kovalenttisten sidosten kautta, muodostuu vesimolekyyli.
kemialliset reaktiot tapahtuvat, kun kaksi tai useampi atomi sitoutuu toisiinsa muodostaen molekyylejä tai kun sidotut atomit hajoavat. Kemiallisen reaktion alussa käytettyjä aineita kutsutaan reaktanteiksi (yleensä kemiallisen yhtälön vasemmalla puolella) ja reaktion lopussa olevia aineita kutsutaan tuotteiksi (yleensä kemiallisen yhtälön oikealla puolella). Reagoivien aineiden ja tuotteiden väliin piirretään tyypillisesti nuoli osoittamaan kemiallisen reaktion suuntaa; tämä suunta ei aina ole ”yksisuuntainen katu.”Edellä esitetyn vesimolekyylin synnylle kemiallinen yhtälö olisi:
2h + O → H2O
esimerkki yksinkertaisesta kemiallisesta reaktiosta on vetyperoksidimolekyylien hajoaminen, joista jokainen koostuu kahdesta vetyatomista, jotka ovat sitoutuneet kahteen happiatomiin (H2O2). Reagoiva vetyperoksidi hajoaa vedeksi, jossa on yksi kahteen vetyatomiin sitoutunut happiatomi (H2O), ja hapeksi, joka koostuu kahdesta sitoutuneesta happiatomista (O2). Alla olevassa yhtälössä reaktiossa on kaksi vetyperoksidimolekyyliä ja kaksi vesimolekyyliä. Tämä on esimerkki tasapainoisesta kemiallisesta yhtälöstä, jossa jokaisen alkuaineen atomien lukumäärä on sama yhtälön kummallakin puolella. Aineen säilymislain mukaan atomien määrän ennen kemiallista reaktiota ja sen jälkeen tulee olla yhtä suuri, jolloin atomeja Ei normaalioloissa synny tai tuhoudu.
2h2o2 (vetyperoksidi) → 2H2O(vesi) + O2 (happi)
vaikka kaikki reaktion reaktantit ja tuotteet ovat molekyylejä (jokainen atomi pysyy sitoutuneena ainakin yhteen muuhun atomiin), tässä reaktiossa vain vetyperoksidi ja vesi edustavat molekyylien alaluokkaa, joka tunnetaan yhdisteinä: ne sisältävät useamman kuin yhden alkuainetyypin atomeja. Molekyylihappi taas, kuten kuvassa 2 esitetään, koostuu kahdesta kaksinkertaisesti sitoutuneesta happiatomista, eikä sitä luokitella yhdisteeksi vaan alkuaineeksi.
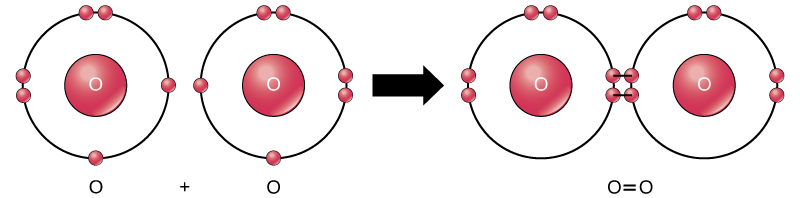
kuva 2. O2-molekyylin happiatomit yhdistyvät kaksoissidoksella.
jotkin kemialliset reaktiot, kuten edellä esitetty, voivat edetä yhteen suuntaan, kunnes reaktantit on käytetty loppuun. Näitä reaktioita kuvaavat yhtälöt sisältävät yksisuuntaisen nuolen ja ovat peruuttamattomia. Palautuvia reaktioita ovat ne, jotka voivat mennä kumpaan suuntaan tahansa. Palautuvissa reaktioissa reaktantit muuttuvat tuotteiksi, mutta kun tuotteen pitoisuus ylittää tietyn kynnysarvon (tietylle reaktiolle ominainen), osa näistä tuotteista muuttuu takaisin reaktanteiksi; tässä vaiheessa tuotteiden ja reaktanttien nimitykset muuttuvat päinvastaisiksi. Tämä edestakaisin jatkuu, kunnes syntyy tietty suhteellinen tasapaino reaktanttien ja tuotteiden välillä—tila, jota kutsutaan tasapainotilaksi. Näitä palautuvien reaktioiden tilanteita merkitään usein kemiallisella yhtälöllä, jossa kaksipäinen nuoli osoittaa kohti sekä reaktantteja että tuotteita.
esimerkiksi ihmisen veressä ylimääräiset vetyionit (H+) sitoutuvat bikarbonaatti– ioneihin (HCO3 -) muodostaen tasapainotilan hiilihapon (H2CO3) kanssa. Jos järjestelmään lisättäisiin hiilihappoa, osa siitä muuttuisi bikarbonaatti-ja vetyioneiksi.
HCO3– + H+ ↔ H2CO3
biologisissa reaktioissa tasapainotila on kuitenkin harvoin saavutettavissa, koska reagoivien aineiden tai tuotteiden tai molempien pitoisuudet muuttuvat jatkuvasti, usein niin, että toisen reaktion tuote on toisen reaktion reaktantti. Palatakseni esimerkkiin veren ylimääräisistä vetyioneista, hiilihapon muodostuminen on reaktion pääsuunta. Hiilihappo voi kuitenkin poistua elimistöstä myös hiilidioksidikaasuna (uloshengityksen kautta) sen sijaan, että se muuttuisi takaisin bikarbonaatti-ioniksi, jolloin reaktio ohjautuu oikealle massatoiminnan lakina tunnetun kemiallisen lain mukaan. Nämä reaktiot ovat tärkeitä veren homeostaasin ylläpitämiseksi.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
Yhteenveto: Kemialliset reaktiot ja molekyylit
ulompi elektronikuori määrää, kuinka helposti ja millaisia kemiallisia sidoksia tietty atomi muodostaa. Yhdisteiden muodostuminen kuvataan usein visuaalisesti kemiallisissa yhtälöissä, jotka osoittavat kemiallisiin reaktioihin osallistuvien reaktanttien muodostavan tuotteita.
kokeile sitä
Osallistu!
paranna tätä sivunumeroa enemmän
Leave a Reply