9.4: ionisidos
ionisidosten muodostumisen Energetiikka
Ionisidokset muodostuvat, kun positiivisesti ja negatiivisesti varautuneet ionit pidetään yhdessä sähköstaattisten voimien avulla. Tarkastellaan yhtä ioniparia, yhtä kationia ja yhtä anionia. Miten voimakas niiden vetovoima on? Coulombin lain mukaan kahden varatun hiukkasen välisen sähköstaattisen vetovoiman energia (\(E\)) on verrannollinen varausten suuruuteen ja kääntäen verrannollinen hiukkasten väliseen internukleaariseen etäisyyteen (\(r\)):
\
\
missä jokaisen ionin varausta edustaa symboli Q. suhteellisuusvakio k on yhtä suuri kuin 2,31 × 10-28 J·M. Tämä k: n arvo sisältää yhden elektronin varauksen (1,6022 × 10-19 C) kullekin Ionille. Yhtälö voidaan kirjoittaa myös käyttäen kunkin vakioon sisällytetyn coulombeina (C) ilmaistun ionin varausta. Tällöin suhteellisuusvakio, k, on 8,999 × 109 J·m/C2. Esimerkissä Q1 = +1(1,6022 × 10-19 C) ja Q2 = -1(1,6022 × 10-19 C). Jos Q1: llä ja Q2: lla on vastakkaiset merkit (kuten esimerkiksi NaCl: ssä, jossa Q1 on +1 na+: lle ja Q2 on -1 cl−: lle), E on negatiivinen, mikä tarkoittaa, että energiaa vapautuu, kun vastakkaisesti varautuneet ionit kootaan äärettömältä etäisyydeltä yhteen muodostaen eristetyn ioniparin.
energia vapautuu aina sidoksen muodostuessa ja vastaavasti sidoksen katkaisemiseen tarvitaan aina energiaa.
kuten kuvan \(\PageIndex{1}\) alaosan vihreä käyrä osoittaa, suurin energia vapautuisi ionien ollessa äärettömän lähellä toisiaan, pisteessä r = 0. Koska ionit miehittävät tilaa ja niillä on rakenne, jossa positiivinen ydin on elektronien ympäröimä, ne eivät kuitenkaan voi olla äärettömän lähellä toisiaan. Hyvin lyhyillä etäisyyksillä viereisten ionien elektronien väliset repulsiiviset elektroni–elektroni-vuorovaikutukset voimistuvat kuin vastakkaisilla varauksilla olevien ionien vetovoimaiset vuorovaikutukset, kuten kuvan \(\PageIndex{1}\) yläosan punainen käyrä osoittaa. Systeemin kokonaisenergia on tasapaino houkuttelevien ja vastenmielisten vuorovaikutusten välillä. Kuvan \(\PageIndex{1}\) Violetti käyrä osoittaa, että systeemin kokonaisenergia saavuttaa minimin pisteessä r0, jossa sähköstaattiset repulsiot ja nähtävyydet ovat täsmälleen tasapainossa. Tämä etäisyys on sama kuin kokeellisesti mitattu sidosetäisyys.
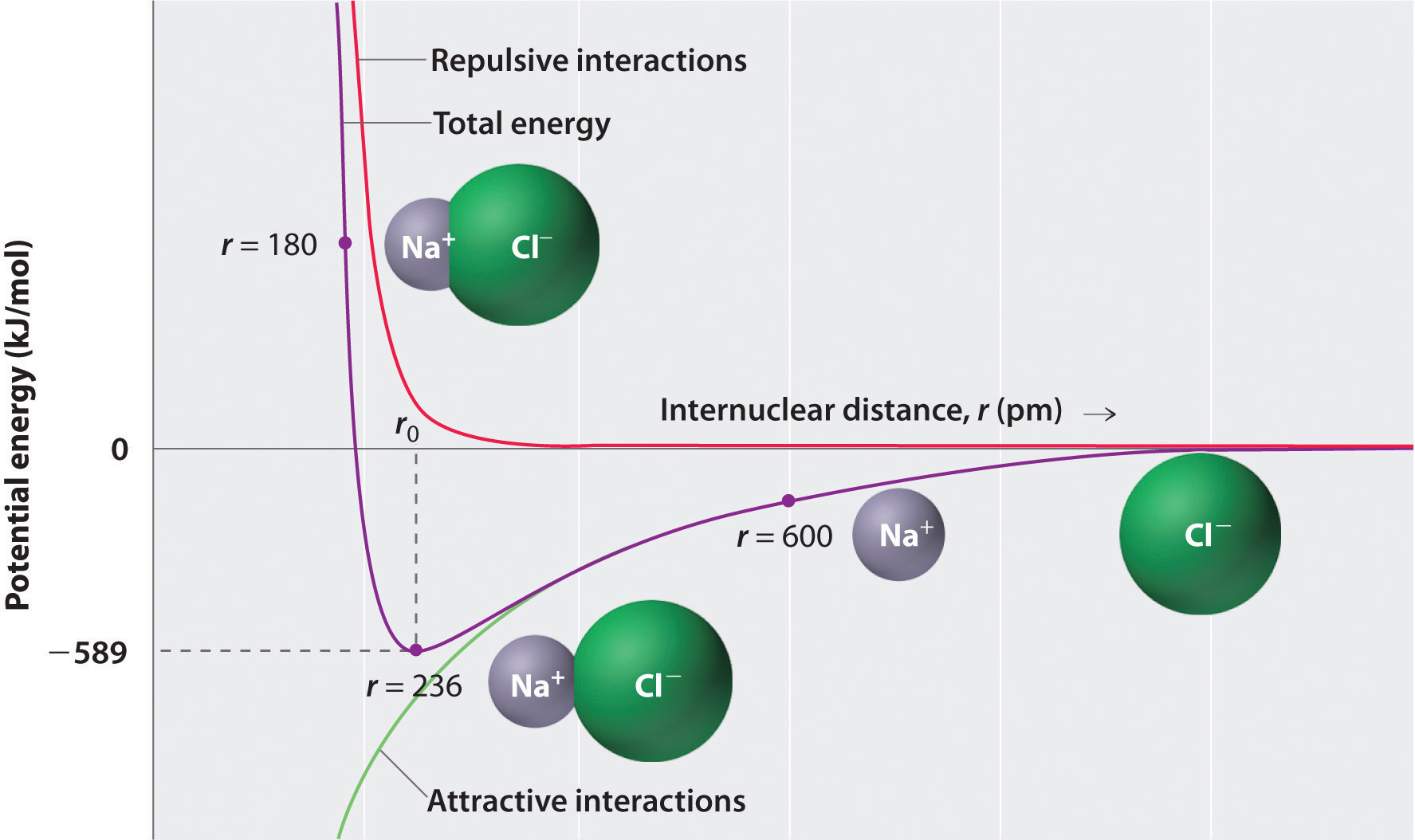
tarkastellaan vapautuvaa energiaa, kun kaasumainen \(Na^+\) ioni ja kaasumainen \(Cl^-\) ioni yhdistyvät R=∞: stä R = R0: een. Koska havaittu kaasufaasin internukleaarinen etäisyys on 236 pm, ioniparin muodostumiseen \(Na^+_{(g)}\) ionista ja \(Cl^-_{(g)}\) ionista liittyvä energiamuutos on seuraava:
\ &= (2.31 \times {10^ {- 28}}\rm{J}\cdot \cancel{m} ) \left( \dfrac{( + 1)( – 1)}{236\; \cancel{pm} \times 10^ {- 12} \cancel{m / pm}} \right) \ \ &= – 9.79 \times 10^{ – 19}\; J/ion\; pair \label{Eq2} \end{align*}\]
negatiivinen arvo ilmaisee, että energiaa vapautuu. Sopimuksemme on, että jos kemiallinen prosessi tuottaa energiaa ulkomaailmalle, energiamuutos on negatiivinen. Jos se vaatii energiaa, energiamuutos on positiivinen. Jotta voidaan laskea NaCl-parien moolin muodostumisen energiamuutos, meidän on kerrottava energia ioniparia kohti Avogadron luvulla:
\
Tämä on energia, joka vapautuu, kun muodostuu 1 mol kaasumaisia ionipareja, ei silloin, kun 1 mol positiivisia ja negatiivisia ioneja tiivistyy muodostaen kiteisen hilan. Hilarakenteen pitkän kantaman vuorovaikutusten vuoksi tämä energia ei vastaa suoraan kiteisen kiinteän aineen hilaenergiaa. Suuri negatiivinen arvo kuitenkin osoittaa, että positiivisten ja negatiivisten ionien saattaminen yhteen on energeettisesti hyvin suotuisaa riippumatta siitä, muodostuuko ionipari vai kiteinen hila.
tiivistämme tärkeät kohdat ionisesta sidoksesta:
- R0: ssä ionit ovat stabiilimpia (niiden potentiaalienergia on pienempi) kuin äärettömällä internukleaarisella etäisyydellä. Kun vastakkaisesti varautuneet ionit saadaan yhteen arvosta r = ∞ arvoon r = r0, systeemin energia alenee (energia vapautuu).
- koska potentiaalienergia on alhainen R0: ssä, systeemiin on lisättävä energiaa ionien erottamiseksi. Tarvittavan energian määrä on sidosenergiaa.
- systeemin energia saavuttaa minimin tietyllä ydinetäisyydellä (sidosetäisyydellä).
esimerkki \(\PageIndex{2}\): LiF
lasketaan vapautuvan energian määrä, kun erotetuista ioneista muodostuu 1 mol kaasumaisia Li+F− ionipareja. Kaasufaasissa havaittu ydinetäisyys on 156 pm.
annettu: kationi ja anioni, määrä ja ydinetäisyys
pyydettiin: kaasumaisten ioniparien muodostumisesta vapautunut energia
strategia:
korvaa sopivat arvot yhtälöksi \(\ref{Eq1b}\), jotta saadaan yhden ioniparin muodostumisessa vapautunut energia ja kerrotaan sitten tämä arvo Avogadron luvulla, jotta saadaan vapautunut energia moolia kohti.
ratkaisu:
lisäämällä li+F− arvot yhtälöön \(\ref{Eq1b}\) (missä Q1 = +1, Q2 = -1 ja r = 156 pm), huomaamme, että yhden Li+F− ioniparin muodostumiseen liittyvä energia on
\ &=\left(2.31 \times 10^{-28} J⋅\cancel{m} \right) \left(\dfrac{\Text{(+1)(-1)}}{156\; pm \times 10^{-12} \cancel{m / pm}} \right)\\ &=-1,48 \times 10^{-18} \end{align*}\]
silloin vapautuva energia li+F− ioniparien moolia kohti on
\ &-891 \;kJ / mol \end{align*}\]
koska Li+ ja F− ovat pienempiä kuin Na+ ja Cl− (KS.kohta 7.3), internukleaarinen etäisyys LiF: ssä on lyhyempi kuin NaCl: ssä. Näin ollen yhtälön \(\ref{Eq1b}\) mukaisesti vapautuu paljon enemmän energiaa, kun muodostuu 1 mol kaasumaisia Li+F− ionipareja (-891 kJ/mol) kuin kun muodostuu 1 mol kaasumaisia Na+Cl− ionipareja (-589 kJ/mol).
harjoitus \(\PageIndex{2}\): magnesiumoksidi
lasketaan vapautuvan energian määrä, kun erotetuista ioneista muodostuu 1 mol kaasumaisia \(\ce{MgO}\) ionipareja. Kaasufaasin ydinetäisyys on 175 pm.
vastaus
-3180 kJ / mol = -3,18 × 103 kJ / mol
Leave a Reply