3.4: Rutherford’ s Experiment – the Nuclear Model of the Atom
Atoms and Gold
vuonna 1911 Rutherford ja hänen työtoverinsa Hans Geiger ja Ernest Marsden aloittivat sarjan uraauurtavia kokeita, jotka muuttaisivat täysin hyväksytyn atomin mallin. He pommittivat hyvin ohuita kultafoliolevyjä nopeasti liikkuvilla alfahiukkasilla.

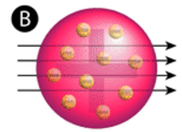

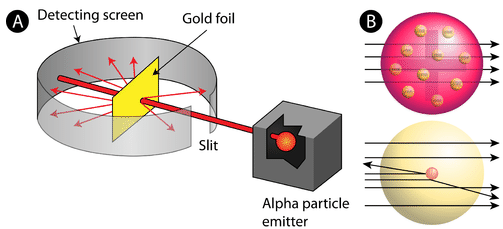
kuva \(\PageIndex{2}\) (A) Rutherfordin gold foil-kokeen kokeellinen asetelma: alfahiukkasia päästänyt radioaktiivinen alkuaine ohjattiin kohti ohutta kultafolioarkkia, jonka ympärillä oli kuvaruutu, joka mahdollisti poikkeutuneiden hiukkasten havaitsemisen. B) luumuvanukkasmallin (top) mukaan kaikkien alfahiukkasten olisi pitänyt kulkea kultafolion läpi vain vähän tai ei lainkaan taipuen. Rutherford havaitsi, että pieni osa alfahiukkasista taipui suurissa kulmissa, mikä voitiin selittää atomilla, jonka keskellä (pohjassa) oli hyvin pieni, tiheä, positiivisesti varautunut ydin.
hyväksytyn atomimallin mukaan, jossa atomin massa ja varaus jakautuvat tasaisesti koko atomiin, tutkijat olettivat, että kaikki alfahiukkaset kulkisivat kultafolion läpi vain hieman taipuen tai eivät lainkaan. Yllättävää kyllä, kuten kuvassa \(\PageIndex{2}\) näkyy (vaikka suurin osa alfahiukkasista oli todellakin havaitsemattomia, hyvin pieni osa (noin 1 8000 hiukkasesta) kimposi kultafoliosta hyvin suurissa kulmissa. Jotkut jopa ohjattiin takaisin lähteelle. Mikään aikaisempi tieto ei ollut valmistanut heitä tähän löytöön. Rutherford huudahti kuuluisassa sitaatissa, että se oli ”kuin olisit ampunut 15-tuumaisen kranaatin kudospalasta ja se tuli takaisin ja osui sinuun.”
Rutherfordin oli keksittävä kokonaan uusi malli atomista, jotta hän voisi selittää tuloksensa. Koska suurin osa alfahiukkasista oli kulkenut kullan läpi, hän päätteli, että suurin osa atomista oli tyhjää tilaa. Sitä vastoin hiukkasten, jotka taipuivat voimakkaasti, on täytynyt kokea suunnattoman voimakas voima atomin sisällä. Hän päätteli, että kaikki positiivinen varaus ja suurin osa atomin massasta täytyy keskittää hyvin pieneen tilaan atomin sisäosiin, jota hän kutsui ytimeksi. Ydin on atomin pikkuruinen, tiheä keskusydin, joka koostuu protoneista ja neutroneista.
Rutherfordin atomimallia alettiin kutsua ydinmalliksi. Atomissa protonit ja neutronit, jotka käsittävät lähes koko atomin massan, sijaitsevat ytimessä atomin keskellä. Elektronit jakautuvat ytimen ympärille ja vievät suurimman osan atomin tilavuudesta. On syytä korostaa, kuinka pieni ydin on muuhun atomiin verrattuna. Jos voisimme räjäyttää atomin suuren ammattilaisjalkapallostadionin kokoiseksi, ydin olisi suunnilleen marmorin kokoinen.
Rutherfordin malli osoittautui tärkeäksi askeleeksi kohti atomin täydellistä ymmärtämistä. Se ei kuitenkaan käsitellyt täysin elektronien luonnetta ja tapaa, jolla ne valtasivat ytimen ympärillä olevan valtavan tilan. Tästä ja muista oivalluksista Rutherford sai Nobelin kemianpalkinnon vuonna 1908. Valitettavasti Rutherford olisi halunnut Nobelin fysiikanpalkinnon, koska piti fysiikkaa kemiaa parempana. Hänen mielestään ” kaikki tiede on joko fysiikkaa tai Postimerkkien keräilyä.”
Leave a Reply