1.14: pH: n ja pKa: n erottaminen
suhteellinen happamuus ja pKa-arvot
Hendersonin-Hasselbachin yhtälön soveltaminen on kyky määrittää yhdisteiden suhteellinen happamuus vertaamalla niiden pKa-arvoja. Mitä vahvempi happo, sitä suurempi ionisaatio, sitä pienempi PKA ja sitä matalampi pH yhdiste liuoksessa tuottaa. Orgaanisen kemian tutkimuksessa yhdisteille on esitetty joitakin valittuja pKa-arvoja. Koska orgaanisia reaktioita voidaan suorittaa ei-vesipitoisissa ympäristöissä, pH voi ylittää 14 ja orgaanisten yhdisteiden pKa-arvot voivat olla yli 16. Se on muunnelma tuosta ”Ihmemaa Ozin” repliikistä ”we don’ t live in water anymore.”





on erittäin hyvä idea sitoa muistiin yllä olevien yhdisteiden likimääräiset PKA-alueet. Varoituksen sana: kun käytät pKa-taulukkoa, ole täysin varma, että harkitset oikeaa konjugaattihappoa/emäsparia. Jos pyydetään sanomaan jotain ammoniakin (NH3) emäksisyydestä verrattuna esimerkiksi etoksidi-ioniin (CH3CH2O -), huomioon otettavat asiaankuuluvat pKa-arvot ovat 9,2 (ammoniumionin pKa) ja 16 (etanolin pKa). Näistä luvuista tietää, että etoksidi on vahvempi emäs. Älä tee sitä virhettä, että käytät pKa-arvoa 38: Tämä on ammoniakin PKA, joka toimii happona, ja kertoo kuinka perus NH2-ioni on (hyvin perus!)
* huomautus veden pKa: Veden pKa on 14. Biokemian ja orgaanisen kemian teksteissä arvoksi mainitaan usein 15,7. Näissä teksteissä on virheellisesti laskettu veden konsentraation mooliarvo tasapainovakioksi. Tasapainovakion oikeaan derivointiin liittyy veden aktiivisuus, jonka arvo on 1.
esimerkki
vaikka tämä kurssi alkaa yksittäisillä funktionaalisilla ryhmillä, työskentelemme lopulta mielenkiintoisilla yhdisteillä, jotka sisältävät useita funktionaalisia ryhmiä. Sen tunnistaminen, mitkä vedyt voidaan ionisoida happamiksi protoneiksi ja mitkä vedyt eivät, on hyödyllinen taito. Huomaa tässä esimerkissä, että meidän on arvioitava potentiaalinen happamuus neljässä eri kohdassa molekyyliä.
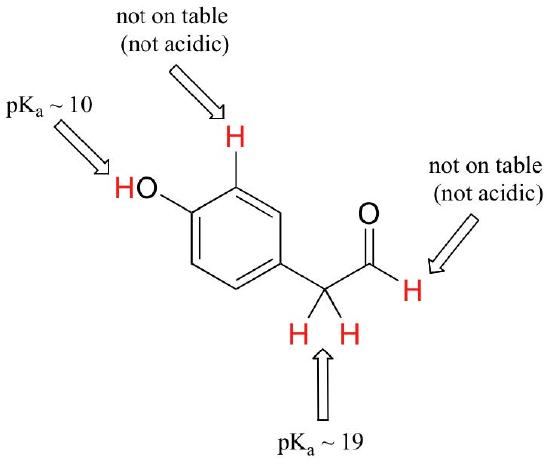
aldehydit ja aromaattiset protonit eivät ole lainkaan happamia (pkavalueita on yli 40 – ei meidän pöydällämme). Karbonyylin vieressä olevan hiilen kaksi protonia ovat hieman happamia, ja PKA-arvot ovat taulukon mukaan noin 19-20. Happamin protoni on fenoliryhmässä, joten jos yhdisteeseen kohdistuisi yksi mooliekvivalentti vahvaa emästä, luovuttaisi tämä protoni.
hapan & Perusympäristöt – kaikki on Reaktiivisuudeltaan suhteellista
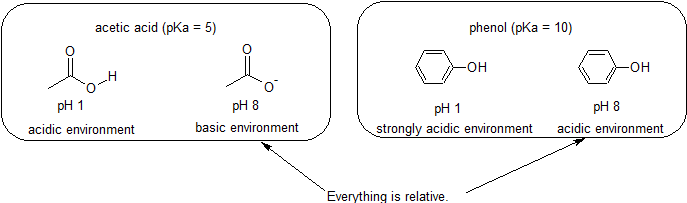
koska tavoitteenamme on ymmärtää dynaamista kemiallista reaktiivisuutta, meidän ei tarvitse tietää yhdisteen protonoituneiden ja suojaamattomien muotojen spesifistä määrää. Meidän on vain tiedettävä, mikä muoto on vallitseva. Kun ympäristön pH on pienempi kuin yhdisteen pKa, ympäristöä pidetään happamana ja yhdiste esiintyy pääosin protonoidussa muodossaan. Kun ympäristön pH on suurempi kuin yhdisteen pKa, ympäristöä pidetään emäksisenä ja yhdiste esiintyy pääosin deprotonoidussa muodossaan.
esimerkiksi etikkahapon pKa on noin 5. PH: ssa 1 ympäristöä pidetään happamana ja etikkahappo esiintyy pääosin protonoidussa muodossaan. PH 8: ssa ympäristöä pidetään emäksisenä, ja etikkahappo deprotonoituu muodostaen asetaattia (CH3CO2-). Vastaavasti fenolin pKa on 10. PH 8: ssa ympäristöä pidetään happamana fenolille ja se pysyy pääasiassa protonoituneena.
on myös tärkeää muistaa, että orgaanisen kemian ei tarvitse esiintyä vedessä, joten pKa-arvot voivat olla jopa 50.
liikunta
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply