Servier – Phlebolymphology
Stáhnout tento problém Zpět na přehled
trombóza dolních končetin:
aktualizace a aktuální
doporučení
Bourgoin-Jallieu, Francie
Abstrakt
Zpočátku, povrchní žilní trombózy (SVT) byla považována za benigní onemocnění, nebo častou komplikací křečových žil. Nedávné studie prokázaly potenciální závažnost SVT a definovaly jeho místo v žilních tromboembolických (VTE) onemocněních spolu s hlubokou žilní trombózou (DVT) a plicní embolií (PE). Souběžná DVT byla zjištěna u 25% až 30% pacientů při prezentaci a PE u 4% až 7% pacientů. Následná VTE byla hlášena u 3 až 20% pacientů, v závislosti na délce sledování. Až donedávna byly testovány četné antikoagulační strategie bez jasně prokázaného klinického přínosu. Nicméně, nedávné CALISTO studie (Srovnání Arixtra v dolní Končetiny Povrchní žilní Trombózy s placebem) validované antikoagulační terapie protokol založený na fondaparinuxu 2,5 mg denně po dobu 45 dnů, což ve aktualizované doporučení pro řízení SVT. Tento článek představí aktualizaci správy SVT dolních končetin a aktuální doporučení a pokyny. Stručně řečeno, všichni pacienti se SVT by měli mít bilaterální duplexní skenování, aby potvrdili diagnózu SVT, určili přesné umístění a rozsah SVT a diagnostikovali nebo vyloučili přítomnost DVT. Pro pacienty se symptomatickou SVT nejméně 5 cm na délku, doporučuje se předepsat profylaktické dávce fondaparinux nebo nízkomolekulární heparin po dobu 45 dnů, přes ne antikoagulace (Stupeň 2B), a kdy náklady léčby fondaparinuxem je přijatelné, doporučuje se použití fondaparinux 2,5 mg denně vs lowmolecular – weight heparin (Stupeň 2C). Doporučení a pokyny však přiřadily tyto léčby nízkým stupněm a zůstávají otázky týkající se řízení SVT. Některé rizikové faktory pro následně rozvoj VTE byly identifikovány, ale další výzkum je třeba definovat podskupiny pacientů s vyšším výskytem VTE po SVT.
Úvod
Povrchní žilní trombózy (SVT) byla považována za benigní onemocnění, nebo častou komplikací křečových žil; nicméně, nedávné studie ukázaly, jejich potenciální závažnosti a definovány jejich místo v rámci žilní tromboembolické (VTE) onemocnění, spolu s hluboké žilní trombózy (DVT) a plicní embolie (PE).
antikoagulační terapie je dnes široce používána místo nesteroidních protizánětlivých léků (NSAID), které byly běžně používány až do posledního desetiletí. Nedávná studie poprvé potvrdila terapeutický protokol.1 přetrvávají však otázky týkající se léčby SVT: (i) je nutná antikoagulační terapie k léčbě všech pacientů se SVT dolních končetin? ii) měly by být použity profylaktické nebo terapeutické dávky? iii) jaká je doporučená doba trvání léčby?; (iv) měla by být léčba stejná pro SVT vyskytující se v křečových žilách a nevarikózních žilách?; (v) lze předvídat rizikové faktory komplikací VTE po SVT?; a (vi) je chirurgický zákrok stále indikován pro léčbu akutní SVT?
tento článek představí důvody aktualizace pro správu SVT nohou a aktuální doporučení a pokyny.
výskyt povrchové žilní trombózy dolních končetin
SVT je považován za běžné onemocnění, ale skutečný výskyt u dospělé populace zůstává neznámý. Nedávná studie provedená ve Francii 2 ukázala,že roční míra diagnózy byla 0, 6%. Byla vyšší u žen a zvyšovala se s postupujícím věkem bez ohledu na pohlaví. Překvapivě, roční diagnóza rychlost SVT byl nižší, než se očekávalo a nižší než roční diagnóza rychlost DVT (o polovinu DVT). Podle jiné francouzské studie, která byla provedena srovnatelnými metodami, byl roční výskyt DVT dolní končetiny a PE 1, 24% A 0, 6%.3
Povrchní žilní trombózy současné hluboké žilní trombózy v prezentaci
POST (Prospektivní Observační Povrchní Tromboflebitida) a OPTIMEV studií (Optimalizace de l’Interrogatoire dans l ‚ évaluation du risque trombo – Embolique Veineux), dvou velkých observačních a epidemiologické studie, nedávno zveřejněné základní údaje na SVT.4,5 celkem 844 pacientů s SVT nohy byly analyzovány v POST studium,4 a DVT nebo PE byla zjištěna u 25% pacientů s SVT na prezentaci a proximální DVT byla diagnostikována u 9,7% pacientů. Musíme zdůraznit, že DVT nebyla souvislá se SVT u 41,9% pacientů s DVT. Celkem 788 pacientů s SVT byli zapsáni v OPTMEV studie,5, kde e SVT byl spojen s DVT na zařazení do 29% pacientů s distální DVT vyskytující se v 59,5% těchto pacientů (128/215; přesné umístění DVT chyběl u 12 pacientů).
tyto údaje potvrzují předchozí studie, které ukazují, že DVT byla spojena se SVT u 23% až 36% pacientů a vykazují soudržnost mezi různými studiemi(tabulka I).2,4-10
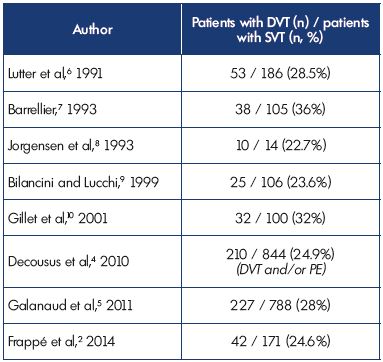
tabulka i. povrchová žilní trombóza se souběžnou hlubokou žílou
trombóza při prezentaci.
zkratky: DVT, hluboká žilní trombóza; PE, plicní embolie; SVT,
povrchová žilní trombóza.
povrchová žilní trombóza spojená s plicní embolií při prezentaci
při zařazení byla symptomatická PE diagnostikována u 3,9% a 6.9% pacientů ve studiích post a OPTIMEV. SVT s PE, ale bez DVT, však představovalo pouze 2, 2% všech SVT s DVT nebo PE. Tyto údaje potvrzují nálezy z předchozích studií (tabulka II).2,4-7,9,10
V praxi, duplexní vyšetření je povinné u pacientů s SVT k potvrzení diagnózy (Obrázek 1), určit přesnou polohu a rozsah SVT, a diagnostikovat nebo vyloučit přítomnost hluboké žilní TROMBÓZY.
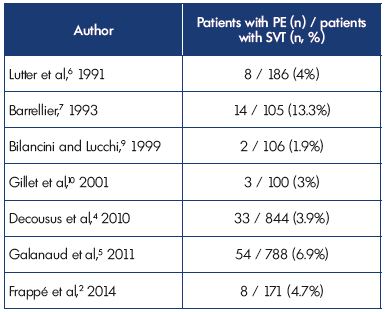
tabulka II. povrchová žilní trombóza se souběžnou plicní embolií při prezentaci.
zkratky: PE, plicní embolie; SVT, povrchová žilní trombóza.
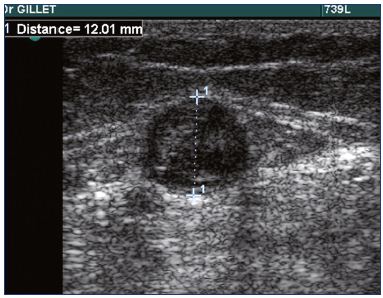
Obrázek 1. Ultrazvuk trombózy malé safénové žíly.

Výsledek a žilní tromboembolické opakování
V literatuře, míra recidivy tromboembolické se pohybuje od 3% do 20% v závislosti na délce sledování. V osobní studii 13 jsme hlásili výskyt symptomatických VTE u 16,4% pacientů s izolovanou SVT, s průměrným sledováním 14,5 měsíců. Příhody VTE zahrnovaly DVT (31%), PE (6%), další SVT v jiném safenózním systému (37,5%) a opakující se SVT ve stejném safenózním systému (25%).
v POST studii, 4 8.3% pacientů s izolovaným SVT na zařazení vyvinutý alespoň 1 symptomatické VTE akce na 3 měsíce (symptomatická DVT, 2.8%; symptomatická PE, o 0,5%, symptomatické prodloužení SVT, 3.3%; a symptomatické recidivy SVT, o 1,9%). V OPTIMEV studie,5 3% pacientů s izolovaným SVT a 5,4% pacientů s SVT spojené s DVT na prezentaci, vyvinula VTE na 3 měsíce; míra s obsahem účinné látky 12,5% na 3-rok follow-up. Ve studii provedené Dewarem a Panpherem se při 6měsíčním sledování vyskytla symptomatická DVT u 4% pacientů s izolovanou SVT.
tyto epidemiologické nálezy ukazují potenciální závažnost SVT. Neměly by být považovány za benigní stav. V důsledku toho bylo jejich místo nyní jasně definováno v rámci nemocí VTE.
Rizikové faktory pro rozvoj tromboembolických událost
vícerozměrné analýzy POST study4 určila mužské pohlaví, anamnéza DVT nebo PE, předchozí rakoviny, a žádné křečové žíly jako rizikové faktory pro symptomatické VTE na 3 měsíce, včetně obnovení nebo prodloužení SVT. V STENOX studie (Povrchní Tromboflebitida léčených Enoxaparinem),15 anamnézou VTE (DVT nebo PE), mužské pohlaví, a těžkou chronickou žilní insuficiencí byly identifikovány jako nezávislé prediktivní faktory pro VTE na 3 měsíce. Pouze těžká chronická žilní nedostatečnost byla nezávislým prediktivním faktorem pro DVT nebo PE. V souhrnné analýze POST a OPTIMEV studium,16 Galanaud et al ukázalo, že mužské pohlaví, rakovina, osobní anamnézou VTE, a recidivy v oblasti nebo saphenopopliteal zapojení výrazně zvyšuje riziko následného VTE, nebo DVT/ PE v jednorozměrné analýze. Ve vícerozměrných analýzách pouze mužské pohlaví významně zvýšilo riziko následné VTE nebo DVT/PE recidivy. Pro rakovinu a osobní anamnézou VTE, upraveny poměry rizik byly pouze mírně pod úrovní statistické významnosti (P=0.06 pro oba), což naznačuje, že pro tyto faktory, studie, jen chybělo dostatečné statistické síly.
V STEFLUX studie (Povrchní Tromboembolie FLUXum),17 které mají index tělesné hmotnosti (BMI) mezi 25 a 30 kg/m2 a kompozitní předchozí SVT a/nebo VTE a/nebo rodinnou anamnézou VTE byly identifikovány jako významné nezávislé rizikové faktory pro VTE události (kompozitní symptomatické a asymptomatické DVT, PE, a SVT opakování nebo rozšíření).
stav žíly
bylo hlášeno, že stav křečových žil ovlivňuje riziko vykazování hluboké žilní trombózy při prezentaci. V POST4 a OPTIMEV studium,5 Svt vyskytující se v non–křečové žíly (NVV-SVT) byly častěji spojeny s průvodním DVT nebo PE než Svt vyskytující se v křečové žíly (VV-SVT). Podobné nálezy byly hlášeny Gorty et al.18
při 3měsíčním sledování ve studii OPTIMEV nebyla izolovaná NVV-SVT spojena s vyšším rizikem nežádoucích výsledků (tj. Izolované NVV-SVT měli vyšší asociaci s symptomatické DVT nebo PE opakování (o 2,7% vs. o 0,6%), ale tento výsledek nedosáhl statistické významnosti (P=0.07).
V POST studie, nepřítomnost křečových žil byl identifikován jako rizikový faktor pro následný rozvoj symptomatické VTE u pacientů s izolovaným symptomatická SVT na prezentaci (P=0.049). Ve studii STEFLUX 17 absence křečových žil byla rizikovým faktorem pro VTE (P=0, 004) po ukončení léčby nízkomolekulárním heparinem.
V placebo skupině CALISTO studie (Srovnání Arixtra v dolní Končetiny Povrchní žilní Trombózy s placebem),1 tromboembolické komplikace se vyskytovaly častěji, když SVT podílí velké safény (GSV), byla prodloužena až do 10 cm recidivy v oblasti junkce (SFJ), které jsou zapojeny žíly nad kolena, a u pacientů s anamnézou VTE.
žilní staze je primárním mechanismem SVT u pacientů s křečovými žilami. Zánět může hrát zásadní roli při tvorbě trombů u pacientů bez křečových žil; tím vzniká vyšší riziko klinicky závažnějšího tromboembolismu. Vyšetření na trombofilie se nedoporučuje pro rutinní péče o pacienty s NVV-SVT, i když údaje z literatury ukázal, že trombofilie bylo časté v této situaci. V osobní prospektivní studie,10 identifikovali jsme trombofilie u 50% pacientů s NVV-SVT, zatímco pouze 15% pacientů s VV-SVT měl trombofilie. V jiné prospektivní studii zahrnující 42 pacientů s NVV-SVT, 19 jsme identifikovali trombofilii u 20 (47,6%) pacientů. Nejčastější trombofilie byla způsobena mutací heterozygotního faktoru V Leiden. Ve studii zahrnující 63 pacientů s izolovanou NVV-SVT identifikovalo 20 Martinelli et al trombofilii u 30% pacientů. Po vyloučení okultního karcinomu se doporučuje Screening na trombofilii, zejména u pacientů s progresí trombu navzdory vhodné antikoagulační terapii.11,21
léčba povrchové žilní trombózy
léčba SVT byla vždy kontroverzním tématem. Jsou hlášeny velké rozdíly v léčbě, zejména pokud jde o antikoagulační terapii. POST studie 4, která byla provedena ve Francii mezi březnem 2005 a říjnem 2006, poskytla zajímavé informace týkající se léčby SVT. Celkem 634 pacientů mělo při zařazení izolovanou SVT. Informace o léčbě, kterou dostali během 3měsíčního období pozorování, byly k dispozici u 597 pacientů, přičemž 90,5% pacientů dostalo jedno nebo více antikoagulačních léků. Z pacientů léčených antikoagulační terapií dostalo 63% terapeutické dávky, 36,7% profylaktické dávky a 16,8% antagonistů vitaminu K. Doba trvání léčby byla velmi variabilní. Celkem 47.2% pacientů dostávalo lokální NSAID, 8,2% perorální NSAID a 10% mělo žilní chirurgický zákrok (stripping nebo high-ligation).
tyto údaje ukázaly nutnost objasnit úlohu antikoagulační terapie při léčbě SVT. Použití antikoagulační terapie u pacientů léčících se s SVT byla poprvé zaznamenána v roce 1962 Zollinger et al,22 po pozorování výskytu PE, který byl fatální v 34 (10.1%) ze série 335 pacientů s SVT. Až donedávna, ačkoli byly testovány četné antikoagulační strategie, včetně nefrakcionovaného heparinu nebo nízkomolekulárního heparinu, v profylaktických nebo terapeutických dávkách pro různé doby trvání, žádná z nich jasně neprokázala žádný klinický přínos.
studie STENOX23 byla randomizovaná dvojitě zaslepená studie zahrnující 427 pacientů, která porovnávala nízkomolekulární heparin (enoxaparin v terapeutických a profylaktických dávkách) s NSAID a placebem. Pacienti byli léčeni po dobu 10 dnů s 3měsíčním sledováním. Po 10 dnech bylo ve skupině s placebem více VTE (P24 porovnávala terapeutické vs. profylaktické dávky nodraparinu u 163 pacientů s izolovanou SVT v GSV a pacienti byli léčeni po dobu 1 měsíce. Při 3měsíčním sledování byly výsledky v obou skupinách Podobné (7,2% a 8,6% výskyt VTE; P=0,7), což neprokázalo žádný přínos terapeutické dávky. Během sledování byl pozorován fenomén“ catch-up “ nebo rebound, protože bylo hlášeno mnoho VTE, zejména ve skupině pacientů léčených terapeutickou dávkou. Fenomén „dohánění“ byl také pozorován po přerušení léčby heparinem s nízkou molekulovou hmotností po 1 měsíci ve studii STEFLUX.25 Tyto nálezy, stejně jako ty z STENOX soudu, prosit pro výběr profylaktické dávky nízkomolekulární heparin v SVT. Výskyt většiny obsahem účinné látky v průběhu 2 a 3 měsíce po ukončení léčby nízkomolekulární heparin ve skupině užívajících terapeutické dávky, opět upozorní na problematiku optimální délka antikoagulační terapie.
randomizované, dvojitě zaslepené CALISTO studie1 v porovnání fondaparinux 2,5 mg denně po dobu 45 dnů s placebem v 3002 pacientů s izolovaným symptomatická dolní končetiny SVT, která byla nejméně 5 cm na délku. Hlavní vylučovací kritéria byla léčba rakoviny během předchozích 6 měsíců, DVT nebo PE v předchozích 6 měsících, SVT se nachází v 3 cm SFJ, a těžkou renální insuficiencí (clearance kreatininu 26 2,5 mg fondaparinuxu byl vybrán na myšlence, že profylaktická dávka by být dostatečná k léčbě pacientů s SVT. Kromě toho, tato dávka byla prokázána vyšší účinnost v prevenci obsahem účinné látky po velkých ortopedických operací, než profylaktické dávce nízkomolekulární heparin, a stejně účinný jako terapeutické dávky nízkomolekulární heparin u pacientů s akutní koronární syndromy, což naznačuje, že 2,5 mg fondaparinux by odpovídaly 2008 American College of Chest Physicians (ACCP) recommendations27, že je zastáncem použití profylaktické, nebo střední dávky low-molecular-weight heparin k léčbě pacientů s SVT. Doba trvání 45 dnů byla zvolena, protože doba léčby 30 dnů nebo méně může být příliš krátká, protože většina symptomatických VTE se objevuje po přerušení léčby. Účinnost primární výsledek byl složený z úmrtí z jakékoli příčiny, symptomatické PE, symptomatická DVT, symptomatické prodloužení SFJ, nebo symptomatické recidivy SVT na den 47. U pacientů bylo sledováno 77denní období sledování.
primární výsledek účinnosti se objevil u 0, 9% pacientů ve skupině s fondaparinuxem a 5.9% v placebové skupině (P28
To je zajímavé upozornění na změnu, doporučení ACCP 2008 pokyny.27 musíme však vzít v úvahu, že se jedná o doporučení nízkého stupně (stupeň 2B nebo 2C).
v aktualizaci databáze Cochrane systematický přehled o „léčbě povrchové tromboflebitidy nohy“ dospěl ke stejným závěrům 29,30 Di Nisio et al. Tento přehled byl založen na analýze 30 randomizovaných kontrolovaných studií zahrnujících 6507 účastníků se SVT nohou. Autoři došli k závěru, že profylaktická dávka fondaparinuxu, uvedeny za 6 týdnů, se zdá být platný terapeutickou možnost SVT nohou. Důkazy o perorální léčbě, lokální léčbě nebo chirurgickém zákroku jsou příliš omezené a neposkytují informace pro použití v klinické praxi o účincích těchto léčebných postupů z hlediska progrese VTE a SVT.
chirurgie versus antikoagulační léčba
přehled studií srovnávajících chirurgický zákrok s antikoagulační terapií neprokázal žádný přínos pro chirurgickou léčbu. Míra progrese SVT byla podobná, zatímco incidence VTE a komplikací byla vyšší při chirurgickém zákroku.31 Lozano et al neprokázali žádný rozdíl mezi chirurgickým zákrokem a enoxaparinem po dobu 4 týdnů.32
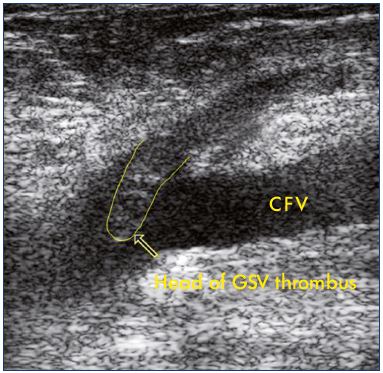
Obrázek 2. Ultrazvuk rozšíření trombózy
velké safénové žíly do společné femorální žíly.
Zkratky: CFV, společné stehenní žíly; GSV, velký safenózní žíly
obrázek 3. Trombóza saphenofemorální křižovatky.
Obrázek s laskavým svolením Dr. Nicolini.

V praxi, většina odborníci doporučují léčbu pacientů s SVT prodloužena na SFJ nebo SPJ s antikoagulační terapie v terapeutických dávkách po dobu 3 měsíců.
závěr
SVT by již nemělo být považováno za benigní onemocnění. Nedávné epidemiologické studie, které zahrnovaly velké množství pacientů, ukázaly potenciální závažnost SVT a jasně definovaly své místo v rámci onemocnění VTE. Souběžná DVT byla zjištěna u 25% až 30% pacientů při prezentaci a PE u 4% až 7% pacientů. V důsledku toho by všichni pacienti se SVT měli mít bilaterální duplexní skenování, aby potvrdili diagnózu SVT, určili přesné umístění a rozsah SVT a diagnostikovali nebo vyloučili přítomnost DVT. Dnes se řízení SVT změnilo a místo NSAID se široce používá antikoagulační terapie. Až do nedávné studie CALISTO Žádný antikoagulační protokol neprokázal jasný klinický přínos. Doporučení byla aktualizována poté, co studie CALISTO potvrdila protokol antikoagulační terapie založený na fondaparinuxu 2, 5 mg denně po dobu 45 dnů. U pacientů se symptomatickou SVT nohou o délce nejméně 5 cm se doporučuje profylaktická dávka fondaparinuxu nebo nízkomolekulárního heparinu po dobu 45 dnů bez antikoagulace (stupeň 2B). Pokud jsou náklady na léčbu fondaparinuxem přijatelné, doporučuje se používat fondaparinux 2, 5 mg denně v profylaktické dávce nízkomolekulárního heparinu (stupeň 2C). Doporučení a pokyny jsou však nízkého stupně a otázky týkající se řízení SVT zůstávají. Byly identifikovány některé rizikové faktory pro následný vývoj VTE, ale je zapotřebí dalšího výzkumu, aby se jasně definovaly podskupiny pacientů s vyšším výskytem VTE po SVT.
1. D ecousus H, Prandoni P, Mismetti P, et al; CALISTO studijní skupina. Fondaparinux pro léčbu povrchové žilní trombózy v nohou. N Engl J Med. 2010;363:1222-1232.
2. Frappé P, Buchmuller-Cordier A, Bertoletti L, et al; STEPH studijní skupina. Roční míra diagnostiky povrchové žilní trombózy dolních končetin: studie STEPH komunitní bázi. J Thromb Haemost. 2014;12:831-838.
3. Oger E; EPI-GETBO studijní skupina. Výskyt žilní tromboembolie: komunitní studie v západní Francii. Trombóza. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; POST Study Group. Povrchová žilní trombóza a žilní tromboembolie: velká, prospektivní epidemiologická studie. Ann Intern Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; OPTIMEV SFMV vyšetřovatelé. Prediktivní faktory pro souběžnou trombózu deepveinu a symptomatickou žilní tromboembolickou recidivu v případě povrchové žilní trombózy. Trombóza. 2011;105:31-39.
6. Lutter KS, Kerr TM, Roedersheimer R, Lohr JM, Sampson MG, Cranley JJ. Povrchová tromboflebitida diagnostikována duplexním skenováním. Operace. 1991;100:42-46.
7. Barrellier MT. Trombózy veineuses superficielles des membres inférieurs . Aktuální Vasc Int. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Hunt JM. Výskyt hluboké žilní trombózy u pacientů s povrchovou tromboflebitidou dolních končetin. Jaromír Jágr 1993; 18: 70-73.
9. Bilancini S, Lucchi m. Les thromboses veineuses superficielles sont-elles polymorphes ? Flébologie. 1999;52:41-43.
10. G illet JL, Perrin M, Cayman R. povrchová žilní trombóza dolních končetin: prospektivní analýza u 100 pacientů . J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Povrchová žilní trombóza: prohlášení o konsensu. Int Angiol. 2012;31:203-216.
12. Nicolaides A. Povrchová žilní trombóza při prevenci a léčbě žilní tromboembolie. Int Angiol. 2013;32:237-242.
13. G illet JL, Perrin M, Cayman R. tromboembolická recidiva po povrchové tromboflebitidě dolních končetin. J. Flebologie. 2002;2:103-118.
14. D ewar C, Panpher s. výskyt hluboké žilní trombózy u pacientů s diagnostikovanou povrchovou tromboflebitidou po předložení ambulantní službě hluboké žilní trombózy na pohotovost. Emerg Med J. 2010; 27: 758-761.
15. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P; skupina STENOX. Faktory prediktivní pro žilní trombotické komplikace u pacientů s izolovanou povrchovou žilní trombózou. Jaromír Jágr, 38: 944-949.
16. G alanaud JP, Bosson JL, Genty C, et al. Povrchová žilní trombóza a recidivující žilní tromboembolie: souhrnná analýza dvou observačních studií. J Thromb Haemost. 2012;10:1004-1011.
17. Cosmi B, Filippini M, Campana F, et al; STEFLUX vyšetřovatelé. Rizikové faktory pro rekurentní příhody u subjektů s povrchovou žilní trombózou v randomizované klinické studii SteFlux (povrchní tromboembolismus Fluxum). Thromb Res. 2014; 133: 196-202.
18. G i S, Patton-Adkins J, DaLanno M, Starr J, Dean S, Satiani B. Povrchní žilní trombózy dolních končetin: analýza rizikových faktorů, a opakování a roli antikoagulace. Vasc Med. 2004;9:1-6.
19. G illet JL, Allaert FA, Perrin m. povrchová tromboflebitida v nevarikózních žilách dolních končetin. Prospektivní analýza u 42 pacientů . J Mal Vasc. 2004;29:263-272.
20. Martinelli I, Cattaneo M, Taioli E, de Stefano V, Chiusolo P, Mannucci PM. Genetické rizikové faktory pro povrchovou žilní trombózu. Trombóza. 1999;82:1215-1217.
21. Milio G, Siragusa S, Malato, Grimaudo S, Pinto A Povrchní žilní trombózy: úloha dědičných nedostatek přirozených antikoagulancií v rozšíření žil do hlubokých. Int Angiol. 2009;28:298- 302.
22. Zollinger RW, Williams RD, Briggs DO. Problémy v diagnostice a léčbě tromboflebitidy. Arch Surg. 1962; 85: 34-40.
23. D ecousus H; studijní skupina enoxaparinu. Pilotní randomizované dvojitě zaslepené srovnání nízkomolekulárního heparinu, nesteroidního protizánětlivého činidla a placeba při léčbě povrchové žilní trombózy. Arch Int Med. 2003;163:1657-1663.
24. Prandoni P, Tormene D, Pesavento R; Vesalio Vyšetřovatelé Skupina. Vysoké vs. nízké dávky nízkomolekulárního heparinu pro léčbu povrchové žilní trombózy nohou: dvojitě zaslepená randomizovaná studie. J Thromb Haemost. 2005;3:1152-1157.
25. Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi A, Bucherini E; STEFLUX vyšetřovatelé. Randomizované doubleblind studium nízkomolekulární heparin (parnaparin) pro povrchové žilní trombózy: STEFLUX (Povrchní Tromboembolie a Fluxum). J Thromb Haemost. 2012;10:1026-1035.
26. D ecousus H, Frappé P, Accassat S, et al. Epidemiologie, diagnostika, léčba a léčba trombózy povrchových žil nohou. Nejlepší Pract Res Clin Hematol. 2012;25:275-284.
27. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ; American College of Chest Physicians. Antitrombotická terapie pro žilní tromboembolickou chorobu: American College of Chest Physicians evidence-Based Clinical Practice Guidelines (8th Edition). Hruď. 2008; 133 (suppl 6): 454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; American College of Chest Physicians. Antitrombotická léčba onemocnění VTE: Antitrombotická terapie a prevence trombózy, 9th ed: American College of Chest Physicians evidence-Based Clinical Practice Guidelines. Hruď. 2012; 141 (suppl 2): e419S-e494S.
29. D i Nisio M, Wichers IM, Middeldorp s. Léčba povrchové tromboflebitidy nohy. Cochrane Database Syst Rev. 2013; 30; 4: CD004982.
30. D i Nisio M, Middeldorp s. Léčba povrchové tromboflebitidy dolních končetin. Jamo. 2014;311:729- 730.
31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Ligace versus antikoagulace: léčba povrchové tromboflebitidy nad kolenem, která nezahrnuje hluboký žilní systém. J Am Sb. 2001; 193: 556-562.
32. Lozano FS, Almazan A. Low-molecularweight heparin versus recidivy v oblasti odpojení pro léčbu nad kolena větší povrchové tromboflebitidy: prospektivní studie. Vasc Endovaskulární Chirurgie 2003; 37: 415-420.
33. Chengelis DL, Bendick PJ, Glover JL, Brown OW, Ranval TJ. Progrese povrchové žilní trombózy k hluboké žilní trombóze. Jaromír Jágr, 24: 745-749.
34. Hingorani A, Ascher e. povrchová žilní tromboflebitida. V: Gloviczki P, ed. Příručka žilních poruch. Pokyny amerického žilního fóra. 3.vydání. Londýn, Spojené království: Hodder Arnold; 2009: 314-319.
Leave a Reply