kovalentní sloučeniny
Nyní máte krátkou představu o tom, proč se různé prvky chovají odlišně. Ale víte, že hlavní část z nich je kvůli „povaze“ vazeb ve sloučeninách. Stejně jako vy a vaši nejlepší přátelé máte řadu rozdílů kvůli „vnitřním“ vlastnostem, tak je tomu u iontových a kovalentních sloučenin. V této kapitole se dozvíme více o konceptu kovalentních sloučenin, podíváme se na jejich vlastnosti a další.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Je to proto, že atomy uvnitř kovalentních molekul jsou velmi pevně drženy pohromadě. Každá molekula je skutečně zcela oddělená a síla přitažlivosti mezi jednotlivými molekulami v kovalentní sloučenině bývá slabá.
potřebujeme velmi málo energie při oddělování molekul. Je to kvůli přitažlivým silám mezi molekulami s absencí celkového elektrického náboje. Kovalentní sloučeniny jsou obvykle plynné molekuly při pokojové teplotě a tlaku. Mohou to být také kapaliny s nízkými relativně nízkými body varu.
tyto vlastnosti lze přičíst jejich slabým intermolekulárním silám, které drží tyto atomy pohromadě. Máme však také mnoho pevných kovalentních sloučenin. Mají nízké teploty tání. Je však zajímavé poznamenat, že malý počet z nich má zcela odlišnou strukturu. Tvoří obrovské struktury, kde je drženo obrovské množství atomů. To je možné díky přítomnosti sdílených elektronů.
tyto obří molekulární struktury jsou v podstatě mřížky tvořené molekulami, které jsou drženy pohromadě strukturou kovalentních vazeb. Tyto kovalentní vazby jsou velmi silné. Mají také tendenci být velmi tvrdé s vysokými body tání, které se liší od většiny kovalentních sloučenin. Příkladem tohoto druhu kovalentních sloučenin je diamant a grafit sítě atomů uhlíku. Zahrnují také oxid křemičitý a atomy kyslíku sítě.
ke Stažení Chemická vazba tahák formátu PDF kliknutím na tlačítko Stáhnout níže.


Procházet více Témat v rámci Chemická vazba A Molekulární Strukturu
- Bond Parametry
- Základy Chemické vazby
- Hybridizace
- Vodíkové vazby
- Iontová nebo Electrovalent Sloučeniny
- Molekulární Orbitální Teorie
- Polarita Vazby
- Rezonančních Struktur
- Valence Bond Teorie
- Teorie VSEPR
Obecné Vlastnosti Kovalentní Sloučeniny
- Kovalentní sloučeniny, obvykle mají nízkou teplotu tání. Výjimkou jsou molekuly oxidu křemičitého a diamantů, které mají vysokou teplotu tání.
- tyto sloučeniny mají nízké teploty varu. To lze přičíst jejich slabé síle přitažlivosti mezi různými vázanými atomy. Van Der Waalsovy síly váží tyto atomy.
- tyto sloučeniny jsou obvykle plyny a kapaliny s nízkou teplotou varu a teplotou tání.
- pevné kovalentní sloučeniny mají měkké struktury jako grafit. Je to kvůli přítomnosti oblaku elektronů mezi každou vrstvou atomů uhlíku.
- tyto sloučeniny jsou nevodiče elektrického náboje. Absence nabitých iontů je hlavním důvodem. Výjimkou je grafit, kde vidíme oblak elektronů. Díky tomu je grafit dobrým vodičem.
- jsou také špatnými vodiči tepla. Jejich molekuly postrádají volné elektrony a to brání toku tepelné energie.
- kovalentní sloučeniny nemají polární vlastnosti jako obecnou vlastnost. Proto jsou tyto sloučeniny nerozpustné ve vodě. Molekuly vody nejsou zcela neutrální a lehce negativní náboj na atomu kyslíku a mírný pozitivní náboj na vodíku atomy a od kovalentní sloučeniny jsou tvořeny z neutrální molekuly nebo molekuly s drobnými poplatky, a proto nejsou přitahuje molekuly vody silně.
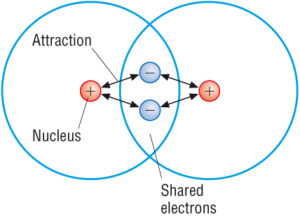
(Zdroj: Google)
fyzikální a chemické vlastnosti
- kapalné kovalentní sloučeniny se odpařují. To znamená, že molekuly kapalin a pevných látek ztrácí ze svého povrchu do vzduchu.
- tyto sloučeniny mají velmi menší afinitu mezi svými molekulami.
- různé kovalentní sloučeniny mají své vlastní charakteristicky tvarované molekuly. Jejich vazby jsou zaměřeny na předem nastavené úhly.
- některé sloučeniny, zejména léky, jsou rozpustné ve vodě. Zbytek je rozpustný v oleji.
- Většinou kovalentní sloučeniny jsou non-polární nebo mají velmi malou tendenci rozdělit úplně formě iontů, a tedy nikdy vést elektřinu.
- při normální teplotě a tlaku najdeme tyto sloučeniny buď jako kapaliny nebo plyny. Existují však také pevné látky a mají vyšší molekulovou hmotnost.
- krystaly kovalentních sloučenin jsou dvou typů: takové, které mají slabou van der Waalovu sílu, která je drží pohromadě jako v jódu. Ty jsou snadno tavitelné a těkavé, ostatní mají velkou síť atomů, které vytvářejí makromolekuly.
- tyto sloučeniny jsou rozpustné v organických rozpouštědlech, jako je ether a benzen.
- kovalentní vazby mají směrovou povahu. Proto, vykazují fenomén izomerie.
- kovalentní sloučeniny mají většinou velmi pomalou rychlost reakcí, na rozdíl od různých iontových sloučenin.
vyřešeno příklady pro vás
otázka: Proč nejsou kovalentní sloučeniny rozpustné ve vodě?
odpověď: molekuly vody nejsou absolutně neutrální. Tyto molekuly mají mírný záporný náboj na atomu kyslíku a mírné kladné náboje na atomech vodíku. Na druhé straně víme, že kovalentní sloučeniny jsou tvořeny neutrálními molekulami nebo molekulami s mírnými náboji. Z tohoto důvodu nejsou tyto sloučeniny silně přitahovány k molekulám vody.
Leave a Reply