Chlorid sodný
hydroxid sodný Chemické Vlastnosti,Použití,Výroby
Chemické Vlastnosti
hydroxid sodný je bílý, bez zápachu, non-volatile alkalické materiálu uváděného na trh v pevné formě jako granule, vločky, chomáče, nebo tyčinky. Jeho rozpustnost ve vodě je 111% hmotnostních a tlak par 0 mmHg (NIOSH, 1994).
může reagovat s tricholoethylenem (TCE) za vzniku hořlavého dichloracetylenu a s kovy za vzniku plynného vodíku (OEHHA, 1993). Jeho reaktivita s kovy by měla být zvážena, pokud jde o skladovací jednotky a nádoby.
hydroxid sodný je běžně dostupný jako vodný roztok známý jako louh sodný, louh sodný nebo jednoduchý jako louh. Používá se k různým účelům, včetně neutralizace kyseliny; výroba papíru, textilu, plastů, koroze, barviva, barvy, barvy odstraňovač, a mýdlo; rafinace ropy; galvanické pokovování; kovové čištění; praní špinavých peněz; a mytí nádobí. Narůstající využití bylo v nelegální výrobě metamfetaminu.
použití
hydroxid sodný (NaOH) je jednou z nejužitečnějších průmyslových sloučenin sodíku. Je také známý jako louh nebo louh sodný a je jednou z nejsilnějších zásad (vysoká hodnota pH) na trhu domácností. Používá se jako čistič odtoku a trouby a zmýdelňuje tukyvýroba mýdla. Musí být používán s opatrností, protože je také schopen produkovat vážnépohoření kůže.
Popis
hydroxid sodný, také známý jako louh a hydroxid sodný, je vysoce žíravé látky, která se používá používá se v malém množství v kosmetice vytvořit a držet pH produktu.Hydroxid sodný je v našich životech nesmírně důležitou sloučeninou, protože má tolik použití. Je to velmi běžná základna používaná v chemickém průmyslu a používá se pro mnoho věcí, z nichž mnohé se vyskytují v našem každodenním životě. Jedním z nejznámějších použití hydroxidu sodného je jeho použití při ucpávání odtoků. Dodává se v mnoha různých značkách čisticích prostředků, ale jedním z nejběžnějších je Drano. Přichází také ve formě louhového mýdla, které lze použít k mytí prakticky všeho, od nádobí po obličej.
struktura hydroxidu sodného
při pokojové teplotě je hydroxid sodný bílá krystalická pevná látka bez zápachu, která absorbuje vlhkost ze vzduchu. Je to vyrobená látka. Hydroxid sodný je anorganická sloučenina používaná k regulaci hladiny pH nebo slouží jako pufrovací činidlo v kosmetice a výrobcích osobní péče. To byl historicky používán ve složení mýdel, ale je v současné době vidět v různých vzorců, včetně přípravky do koupele, čistící prostředky, vůně, nohy prášky, barvy na vlasy a barvy, make-up, lak na výrobky, osobní čistota výrobky, šampony, holicí přípravky, depilační přípravky, výrobky péče o pleť, opalovací přípravky, stejně jako chemické rovnání vlasů a vlasy vlna. To je také populární přísada v průmyslových rozpouštědel jako chemické základny pro mýdla, čisticí prostředky na trouby, čisticí prostředky a čističe odtokového potrubí, protože jeho schopnost rozpouštět mastnoty, oleje, tuků a bílkovin na základě vkladů, podle Wikipedie. Méně často je hydroxid sodný považován za složku zubních past.
hydroxid sodný je schválen FDA a získal hodnocení GRAS (obecně uznávané jako bezpečné) jako přímá potravinářská přídatná látka. Používá se však především při praní a chemickém peelingu produktů. To je schválen pro použití v kosmetice a produktů osobní péče v různých koncentracích: 5% hmotnostních v nehtové kůžičky rozpouštědel, 2% hmotnostních v rovnání vlasů pro všeobecné použití, o 4,5% hmotnostních v rovnání vlasů pro profesionální použití, a to až do pH 12.7 v depilačních prostředcích, a to až do pH 11 v jiné používá jako regulátor pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Chemické Vlastnosti
hydroxid sodný, NaOH,také odkazoval se na jako hydroxid sodný nebo hydroxid hydrát(a dříve známý jako louh), je bílý,masivní, hygroskopická krystalická látka, která je rozpustná ve vodě,lihu a glycerolu. To taje při 318°C (606OF) a je nejrozšířenější a dostupné alkalické chemikálie. Většina hydroxidu sodného se vyrábí jako koprodukt chloru pomocí elektrolytických buněk;buňky jsou membránového, rtuťového nebo membránového typu. Některý hydroxid sodný je označen jako produkovaný v buňkách; většina se odpaří a prodává se jako 50% a 73% roztoky nebo jako bezvodé kuličky. Většina žíravých koncových použití vyžaduje roztoky relativně nízkých koncentrací. Louh sodný se používá jako analytické činidlo a chemický meziprodukt, ve odmašťování a čištění vany,gumové regenerace a rafinace ropy, v kalících lázní pro tepelné zpracování, oceli,řezání a rozpustné oleje,mýdla a čisticí prostředky, a v široké škále dalších aplikací.
chemické vlastnosti
NaOH je bílý materiál bez zápachu prodávaný jako pelety, vločky, hrudky nebo tyčinky. Vodné roztoky jsou známé jako soda louh
chemické vlastnosti
hydroxid sodný se vyskytuje jako bílá nebo téměř bílá tavená hmota. Je k dispozici v malých peletách, vločkách, tyčinkách a dalších tvarech nebo formách. Je tvrdý a křehký a vykazuje krystalickou zlomeninu. Sodíkhydroxid je velmi rozpustný a při vystavení vzduchu rychle vstřebává oxid uhličitý a vodu.
Fyzikální vlastnosti
Bílá orthorhombic krystalů, vyrábí ve formě pelet, kostky, tyčinky, kuličky, lupínky, vločky nebo řešení; hygroskopický, velmi žíravé; rychle absorbuje CO2 a vodu ze vzduchu; hustota 2.13 g/cm3, taje při 323°C; vypařuje na 1388°C; tlak páry 1 torr na 739°C a 5 torr na 843°C, velmi snadno rozpustná ve vodě (110 g/100 ml při pokojové teplotě), vytváří teplo na rozpuštění; vodné roztoky silně zásaditá, pH 0,5% roztoku o 13 a 0,05% roztoku asi 12; rozpustný v methanolu, ethanolu a glycerolu (23.8 g/100 mL methanolu a 13.9 g / 100 mL ethanolu při okolní teplotě.).
používá
hydroxid sodný je jedním z nejpoužívanějšíchchemikálie. To se používá k neutralizaci kyselin; tomake sodné soli; k vysrážení kovů svých hydroxidy; rafinace ropy; v thesaponification esterů; v léčbě ofcellulose, plastů a pryže; a v numeroussynthetic a analytické aplikace.
použití
hydroxid sodný se komerčně prodává jako bezvodé vločky nebo pelety nebo jako 50% nebo 73% vodné roztoky. Má nespočet průmyslových využití a je jednou z 10 nejlepších chemických látek z hlediska výroby a použití v globálním měřítku. Ročně se používá přibližně 15 milionů tun hydroxidu sodného. Jeho největší využití, které spotřebovává asi polovinu své produkce, je jako základ při výrobě jiných chemikálií. Používá se k regulaci pH a neutralizaci kyselin v chemických procesech. Papírenský průmysl rozsáhle využívá hydroxid sodný v procesu rozvlákňování. Hydroxid sodný se používá k oddělení vláken rozpuštěním spojovacího ligninu. Používá se podobným způsobem při výrobě hedvábí z celulózy. Hydroxid sodný je klíčovou chemické látky v mýdla průmyslu.V zmýdelnění proces, triglyceridy získané z zvířat a rostlin jsou vytápěny v základním řešení dát glycerolu a mýdla:
hydroxid sodný se používá v textilním průmyslu pro bělení a zacházet s textilií, aby makethem barvivo mnohem snadněji. Ropný průmysl používá hydroxid sodný ve vrtných bahnech a baktericid asa. Chlornan sodný (NaOCl) se hojně používá k čištění a jako dezinfekční prostředek.Běžné bělidlo pro domácnost se skládá z asi 5% roztoku chlornanu sodného. Chlornan sodný se připravuje reakcí chloru s hydroxidem sodným: Cl2 (g) + 2NaOH(aq) →naocl(aq) + NaCl(aq) + H2O (l). Hydroxid sodný se používá v potravinářském průmyslu k čištěnía loupání ovoce a zeleniny. Hydroxid sodný je vedlejší složkou v mnoha běžnýchprodukty domácnosti, ale v několika případech může představovat více než polovinu produktu. Dranokrystaly obsahují mezi 30% a 60% hydroxidu sodného a některé čisticí prostředky mohou sestávat ze 100% hydroxidu sodného.
použití
hydroxid sodný je alkálie, která je rozpustná ve vodě a má rozpustnost 1 g v 1 ml vody. používá se k ničení hořkých chemikálií v olivách, které se mají stát černými olivami. funguje také k neutralizaci kyselin v různých potravinářských výrobcích.
použití
hydroxid sodný se používá k úpravě pH produktu tak, aby byl přijatelnější pro pokožku. To je obyčejně odkazoval se na jako louh sodný, a často slouží jako chemické činidlo při výrobě mýdla. Pokud je příliš koncentrovaný, může způsobit silné podráždění kůže.
použití
hydroxid sodný je jednou z nejdůležitějších průmyslových chemikálií. V objemu je v první desítce chemikálií vyráběných ve Spojených státech. Používá se při výrobě velkého počtu sloučenin včetně několika sodné soli, v léčbě celulózy pro výrobu hedvábí a celofánu, a při výrobě mýdel, detergentů, buničiny a papíru. Hydroxid sodný je běžné neutralizační činidlo pro kyseliny při acidobazických titracích a rafinaci ropy. Další významnou aplikací je extrakce kovů z jejich rud, kde alkalických fusion jako fusion s hydroxidem sodným, často je aplikován na otevřené rudy. Kromě toho se hydroxid sodný používá k vysrážení kovů jako hydroxidů. Jiná použití jsou v rekultivaci gumy, rozpouštění kaseinu v výroba plastů, rafinace rostlinných olejů, zpracování textilu, jako eluant v iontové chromatografii, leptání a elektrolytické pokovování, a jako laboratorní činidla. Hydroxid sodný se také používá jako silná báze v mnoha organických syntézách a reakcích katalyzovaných bází.
Použití
NaOH roztoky se používají k neutralizaci kyselin, a aby sodné soli, např. při rafinaci ropy odstranit sírové a organických kyselin; k léčbě celulóza na výrobu viskózového hedvábí a celofánu; v rekultivaci gumy, aby se rozpustil z tkaniny; při výrobě plastů k rozpuštění kaseinu. NaOH roztoky rozpouštějí tuky a tvoří mýdla; sraženina alkaloidů (mety) a většinu kovů (jako hydroxidy) z vodních roztoků jejich solí. Farmaceutická pomoc (alkalizátor).
přípravek
hydroxid sodný se vyrábí společně s chlorem elektrolýzou roztoku chloridu sodného. Různé typy elektrolytických článků se používají komerčně. Zahrnují rtuťovou buňku, membránovou buňku a membránovou buňku.
nasycený roztok solanky se elektrolyzuje. Plynný chlor se uvolňuje na anodě a sodíkový iont na katodě. Rozklad vody produkuje vodíkové a hydroxidové ionty. Hydroxidový ion se kombinuje se sodným iontem tvořícím NaOH. Celkový elektrolytické reakce může být reprezentován jako:
2Na+ + 2Cl-+ 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
rtuťových probíhá ve dvou fázích, které se vyskytují odděleně ve dvou buněk. První je známý jako slaném nálevu buňky nebo primárním elektrolyzéru, ve které sodný ion vklady na rtuťové katodě tvoří amalgám, zatímco chlor je plyn osvobozen na anodě:
Na+ + Cl–→ Na-Hg (katoda) + ½Cl2(g) (anoda)
V druhé buňce, známý jako decomposer buňky, grafitu, katoda je použito zatímco amalgám sodíku slouží jako anoda. Voda reaguje s roztokem kovu amalgám v decomposer:
Na-Hg + H2O → Na+ + OH– + ½H2 + Hg
V chlor-alkalických membrány buněk, membrána je zaměstnán na samostatné chloru osvobozen na anodě od hydroxidu sodného a vodíku generovaný na katodě. Bez membrány se vzniklý hydroxid sodný spojí s chlorem za vzniku chlornanu sodného a chlorečnanu. V mnoha buňkách se pro takové oddělení používají azbestové membrány. K dispozici je mnoho typů membránových buněk.
hydroxid sodný se vyrábí buď jako bezvodá pevná látka, nebo jako 50% vodný roztok.
definice
nejdůležitější komerčníkaustika.
výrobní metody
hydroxid sodný se vyrábí elektrolýzou solanky pomocí inertních elektrod. Chlor se vyvíjí jako plyn na anodě avodík se vyvíjí jako plyn na katodě. Odstranění chloridua vodíkové ionty ponechávají sodíkové a hydroxidové ionty v roztoku.Roztok se suší za vzniku pevného hydroxidu sodného.
Druhá metoda používá buňku Kellner-Solvay. Nasycený roztok chloridu sodného se elektrolyzuje mezi uhlíkovou anodou a rtuťovou katodou. V tomto případě se sodík vyrábí napřekatoda spíše než vodík kvůli připravenostisodík se rozpustí v rtuti. Amalgám sodík-rtuť jepak je vystaven vodě a vzniká roztok hydroxidu sodného.
reakce
hydroxid sodný je silně zásaditý a může reagovat s kyselinami za vzniku solí a vody.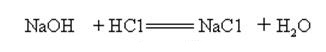
hydroxid sodný reaguje s kyselými oxidy tvoří soli a vody, takže hydroxid sodný mohou být použity k absorpci kyselých plynů v laboratoři nebo průmyslově.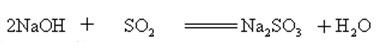
hydroxid sodný může reagovat s vodnými roztoky mnoho kovových solí tvoří sodík soli a kovové hydroxidy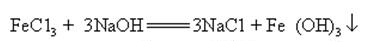
Když hydroxid sodný a amoniak sůl se zahřívá spolu, to může uvolňovat amoniak 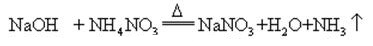
hydroxid sodný je silná žíravina, tak, že skleněné lahve skladování hydroxid sodný řešení musí být gumové zátky a skleněné zátky, by neměly být použity, aby se zabránilo chemické reakci od otevření. Hydroxid sodný je důležitou průmyslovou surovinou, a může být vyráběn elektrolýzou solného roztoku průmyslově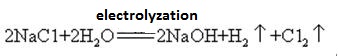
Popis
bílé pevné látky. Korozivní pro kovy a tkáně. Používá se v chemické výrobě, rafinaci ropy,čisticích prostředcích, čisticích prostředcích.
Air & reakce vody
rozpustné ve vodě. Rozpuštění může uvolnit dostatek tepla, aby způsobilo napařování a rozstřikování a zapálilo sousední hořlavý materiál .
reaktivita profil
hydroxid sodný (hydroxid sodný) je silná báze. Reaguje rychle a exotermicky s kyselinami, organickými i anorganickými. Snadno absorbuje vlhkost ze vzduchu za vzniku žíravých polotuhých látek, které napadají hliník a zinek vývojem hořlavého plynného vodíku. Katalyzuje polymeraci acetaldehyd a další polymerizovatelné sloučeniny; tyto reakce se mohou vyskytnout násilně, například akrolein polymerizes s extrémní násilí, když dal v kontaktu s alkalickými materiály, jako je hydroxid sodný . Reaguje s velkým násilím s oxidem fosforečným, když je iniciován lokálním ohřevem . Kontakt (jako sušící činidlo) s tetrahydrofuranu, který často obsahuje peroxidy, může být nebezpečné—explozí došlo v takové používání chemicky podobné hydroxidu draselného . Míchání s některou z následujících látek v uzavřené nádobě způsobené teploty a tlaku na zvýšení: ledová kyselina octová, acetanhydrid, akrolein, chlorohydrin, chlorosulfonic, kyselina ethylen cyanohydrin, glyoxal, kyselina chlorovodíková (36%), kyselina fluorovodíková (48.7%), kyselina dusičná (70%), oleum, propiolactone, kyselina sírová (96%) . Náhodný kontakt mezi žíravým čisticím roztokem (pravděpodobně obsahujícím hydroxid sodný) a Pentolem způsobil prudký výbuch. . Zahřívání směsí methylalkoholu a trichlorbenzenu během pokusu o syntézu vedlo k náhlému zvýšení tlaku a výbuchu . Horký a / nebo koncentrovaný NaOH může způsobit exotermický rozklad hydrochinonu při zvýšené teplotě. (Hospoda NFPA. 491M, 1975, 385)
nebezpečí
žíravé pro tkáň v přítomnosti mois-ture, silně dráždivé pro tkáň (oči ,kůže, sliznicemembrány a horní dýchací cesty), jed požití.
zdravotní riziko
silný korozivní účinek na postižené tkáně. VDECHNUTÍ: prach může způsobit poškození horních cest dýchacích a plic sám, vyrábějící od mírné podráždění nosu, aby pneumonitida. Požití: závažné poškození sliznic; může dojít k těžké tvorbě jizev nebo perforaci. Oční kontakt: způsobuje vážné poškození.
zdravotní riziko
hydroxid sodný je vysoce korozivní látkakterá způsobuje poškození lidských tkání.Jeho působení na kůži je poněkud odlišnéod kyselých popálenin. Neexistuje žádná okamžitá bolest, ale proniká kůží. Není koagulačníprotein, aby se zabránilo jeho dalšímu pronikání, a tak žíravé popáleniny mohou být těžkéa pomalé hojení. Rozlití jeho koncentrovanéroztoky do očí mohou mít za následek těžképodráždění nebo trvalé zranění.
je toxický při požití i vdechnutíjeho prachu. I když orální toxicita o 5-10% roztok hydroxidu sodného byl foundto být nízké u pokusných zvířat, vysoké dávky atgreater koncentrace může způsobit zvracení,vyčerpanost, a kolaps. Perorální letální dávkav králících je 500 mg / kg (NIOSH 1986).
prach hydroxidu sodného nebo aerosoly jsoupodráždí oči, nos a krk. Prodlouženévystavení vysokým koncentracím ve vzduchumůže způsobit ulceraci nosního průchodu.
nebezpečí požáru
nehořlavá látka sama o sobě nehoří, ale může se při zahřátí rozkládat za vzniku korozivních a/nebo toxických výparů. Některé jsou oxidační činidla a mohou vznítit hořlavé látky (dřevo ,papír,olej, oblečení atd.). Při kontaktu s kovy se může vyvinout hořlavý plynný vodík. Kontejnery mohou při zahřátí explodovat.
hořlavost a výbušnost
hydroxid sodný a hydroxid draselný nejsou hořlavé jako pevné látky nebo vodné roztoky.
farmaceutické aplikace
hydroxid sodný je široce používán ve farmaceutických formulacích k úpravě pH roztoků. Může být také použit k reakci se slabýmkyseliny za vzniku solí.
průmyslové použití
hydroxid sodný (NaOH) je považován za nejsilnější alkalický regulátor pH. Žíravá sodaje velmi účinná látka a je vysoce korozivní. Většina hydroxidu sodného se vyrábíelektrolýzou nasycených solanek (NaCl). Hydroxid sodný má velice silný pHregulatingcapability (tj. od pH 7 do pH 14) při relativně nízké dávkování oproti jiným zásadité látky. Komerčně je hydroxid sodný dostupný v bezvodé formě, ale ve většině těžebních aplikací je hydroxid sodný dodáván jako 50% roztok.
v průmyslu zpracování nerostných surovin se hydroxid sodný většinou používá pro kontrolu zásaditosti při zpracování nekovových minerálů. Při flotaci obecných kovů použitíhydroxid sodný je vzácný.
bezpečnostní profil
jed intraperitoneální cestou. Mírně toxický při požití. Hlášené údaje o mutacích. Žíravý dráždivý pro kůži, oči a sliznice. Při zahřátí na rozklad vydává toxické výpary NanO.
Bezpečnost
hydroxid sodný je široce používán ve farmaceutickém a foodindustries a je obecně považován za netoxický materiál na lowconcentrations. Při vysokých koncentracích je žíravý dráždivýkůže, očí a sliznic.
LD50 (myš, IP): 0,04 g/kg
LD50 (králík, orální): 0,5 g/kg
Potenciální Expozice
NaOH se používá k neutralizaci kyselin, a aby sodné soli při rafinaci ropy, viskózové hedvábí; celofán, plastové výroby; a při rekultivaci roztoků jejich solí. Používá se při výrobě mercerovaná bavlna, papír, výbušniny, barviva a při čištění kovů; elektrolytické získávání zinku; cínování; oxid povlakem; praní, bělení, mytí nádobí, a to se používá v chemickém průmyslu.
skladování
splashgoggles a nepropustné rukavice by se měly při manipulaci s těmito látkami nosit po celou dobu, aby se zabránilo kontaktu s očima a pokožkou. Operace s hydroxidy kovuroztoky, které mají potenciál vytvářet aerosoly, by měly být prováděny ve fumeodě, aby se zabránilo expozici inhalací. NaOH a KOH vytvářejí značné teplokdyž se rozpustí ve vodě; při míchání s vodou vždy přidávejte louhy pomalu do vody a nepřetržitě míchejte. Nikdy nepřidávejte vodu v omezeném množství na pevné látkyhydroxidy. Nádoby s hydroxidy by měly být skladovány na chladném a suchém místě, odděleny od kyselin a nekompatibilních látek.
skladování
hydroxid sodný by měl být skladován ve vzduchotěsné nekovové nádobě na chladném a suchém místě. Při vystavení vzduchu sodíkhydroxid rychle absorbuje vlhkost a zkapalňuje, ale následněse díky absorpci oxidu uhličitého a tvorbě uhličitanu sodného opět stává pevným.
doprava
UN1823 NaOH, pevná látka, třída nebezpečnosti: 8; štítky: 8-korozivní materiál. UN1824 NaOH, roztok, třída Nebezpečnosti: 8; Štítky: 8-Žíravé materiál
Metody Čištění
Běžné nečistoty, vodu a uhličitan sodný. Hydroxid sodný může být čištěná rozpuštěním 100g v 1L čistého EtOH filtrace řešení ve vakuu přes jemné slinuté sklo disk odstranění nerozpustných uhličitanů a halogenidů. (Tato a následné operace by měly být prováděny v suché krabici bez CO2.) Roztok se zahustí se ve vakuu, za použití mírné topení, aby husté kaše z mono-alkoholát, který je přemístěn do hrubé slinuté sklo disk a evakuováno zdarma matka alkohol. Po umytí krystaly několikrát se čistí alkoholu odstranit stopy vody, se suší ve vakuu, s mírným vytápění, pro o 30hours se rozkládají alkoholát, zanechává jemný bílý krystalický prášek . LOUH. Roztoky hydroxidu sodného (louh), 14.77. Uhličitanový iont může být odstraněn průchodem kolonou pro výměnu aniontů (jako je Amberlite IRA-400; OH-forma). Kolona by měla být čerstvě připravena z chloridové formy pomalým předchozím průchodem roztoku hydroxidu sodného, dokud Odpadní voda nevydá žádnou zkoušku na chloridové ionty. Po použití může být kolona regenerována promytím zředěným HCl a poté vodou. Podobně se odstraňují další kovové ionty, když se 1M (nebo více zředěný) roztok NaOH prochází kolonou iontoměničové pryskyřice a-1 dowex ve své Na + – formě. Alternativně, uhličitan kontaminace může být snížena tím, oplachování tyčinky NaOH (analytické činidlo kvalita) se rychle s H2O, pak rozpuštěním v destilované H2O, nebo tím, že připravuje koncentrovaný vodný roztok NaOH a čerpání z čirý supernatant kapaliny. (Nerozpustný Na2CO3 zůstává pozadu.) Kontaminace uhličitanem může být snížena přidáním mírného přebytku koncentrovaného BaCl2 nebo Ba (OH) 2 do roztoku NaOH, dobře protřepáním a umožněním usazování sraženiny BaCO3. Pokud je přítomnost Ba v roztoku nepřijatelná, lze použít elektrolytické čištění. Například, sodík amalgám je připraven elektrolýzou 3L, 30% NaOH s 500 ml čisté rtuti pro katody, a platinové anody, kolem 15 Faradayovy na 4Amps, v silnostěnné polyetylenové láhve. Láhev je pak vybaven vstupní a výstupní trubky, strávili řešením je propláchnout tím, že bez CO2 N2. Amalgám je pak důkladně omýt velkým objemem deionizované vody (elektrolýza proud zapnutý, aby se minimalizovalo ztráty Na). Konečně, čistý ocelové tyče je umístěn v kontaktu v roztoku s amalgám (pro usnadnění hydrogen evolution), reakce je povoleno pokračovat v plavbě, dokud vhodné koncentrace je dosaženo, než byl přemístěn do skladovací nádoby a ředí podle potřeby .
Inkompatibility
silná báze a silné oxidační činidlo. Násilná reakce s kyselinou. Neslučitelné s vodou; hořlavé kapaliny; organické halogeny, nitromethan a nitrosloučeniny, hořlavé látky. Rychle absorbuje oxid uhličitý a vodu ze vzduchu. Kontakt s vlhkostí nebo vodou může vytvářet teplo. Korozivní pro kovy. Kontakt se zinkem, hliníkem, cínem a olovem v přítomnosti vlhkosti, za vzniku výbušného plynného vodíku. Napadá některé formy plastů, gumy nebo povlaků.
Inkompatibility
hydroxid sodný je silná báze a je nekompatibilní s jakoukoli sloučeninou, která snadno podléhá hydrolýze nebo oxidaci. Bude reagovat s kyselinami, estery a ethery, zejména ve vodném roztoku.
likvidace odpadu
vypusťte do nádrže obsahující vodu, neutralizujte a poté propláchněte do kanalizace vodou.
regulační Status
Gras uvedeny. Přijato pro použití jako potravinářská přídatná látka v Evropě.Zahrnuto v databázi neaktivních složek FDA (dentalpřípravky; injekce; inhalace; nosní, oční, orální,Otické, rektální, topické a vaginální přípravky). Zahrnuto v neparenterálních a parenterálních léčivých přípravcích licencovaných ve Velké Británii. Zahrnuto vkanadský seznam přijatelných neléčivých složek.
Leave a Reply