Chemie: co jsou kyseliny a Zásady?
co jsou kyseliny a Zásady?
i když jsem říkal, že kyseliny a zásady není těžké pochopit, mám špatnou zprávu: Existuje ne jeden, ale tři společné definice se používá k popisu kyselin a zásad: Arrheniovy kyseliny a zásady, Brnsted-Lowryho kyseliny a zásady, a lewisovými kyselinami a bázemi. I když to dělá to zvuk, jako když budete muset naučit o kyselin a zásad třikrát, dobrá zpráva je, že pro mnoho praktických účelů, tyto tři definice jsou zhruba rovnocenné.
Arrheniovy Kyseliny a zásady
Cesta zpět v pozdních 1800s, náš starý přítel Svante Arrhenius přišel s definice kyseliny a zásady při práci na kinetiku problémy.
Podle Arrheniovy, kyseliny jsou sloučeniny, které se rozejít ve vodě, aby z vodíku (H+) ionty. Obvyklým příkladem kyseliny Arrheniové je kyselina chlorovodíková (HCl):
- HCl ? H + + Cl –
vzorce pro kyseliny obvykle začínají vodíkem, i když organické kyseliny jsou výraznou výjimkou. Názvy a vzorce některých běžných kyselin jsou uvedeny v tabulce níže:
| Kyselina Jméno | Vzorec |
|---|---|
| kyselina chlorovodíková | HCl |
| kyselina dusičná | HNO3 |
| kyselina fosforečná | H3PO4 |
| kyselina sírová | H2SO4 |
| kyselina octová | C2H4O2 |
Arrheniovy základny jsou definovány jako sloučeniny, které způsobují tvorbu sodný ion, když se umístil ve vodě. Jedním z příkladů arrheniovy báze je hydroxid sodný (NaOH):
- NaOH ? Na + + OH-
báze mají obvykle ve vzorcích „OH“ , I když existují výjimky. Například čpavek (NH3) neobsahuje hydroxidu ionty, ale tvoří je, když reaguje s vodou:
- NH3 + H2O ? NH4+ + OH-
názvy a vzorce některých společných bází jsou v následující tabulce:
| Základní Název | Vzorec |
|---|---|
| amoniak | NH3 |
| chlorid sodný | KOH |
| chlorid sodný | NaHCO3 |
| uhličitan sodný | Na2CO3 |
| chlorid sodný | NaOH |
Některé oxidy tvoří kyseliny nebo zásady, když se přidá voda. Protože tyto sloučeniny neobsahují žádné ionty H + nebo OH, pokud nereagují s vodou, nazývají se “ anhydridy.“Oxidy nekovů jsou obvykle anhydridy kyselin (při umístění do vody tvoří kyselinu) a oxidy kovů jsou anhydridy bází(při umístění do vody tvoří základnu).
Brnsted-Lowryho Kyseliny a zásady
V časném 1900s, alternativní definice kyselin a zásad navrhl Johannes Brnsted a Thomas Lowry s ohledem na skutečnost, že amoniak může neutralizovat kyselost HCl, i když voda není k dispozici. Tento jev ukázal jim, že amoniak je báze, i když tam není voda kolem vzniku hydroxidových iontů.
Existuje mnoho různých názvy a vzorce používá k popisu ion vodíku. Ačkoli byl vzorec dříve zobrazen jako “ H+“, někdy se píše jako „H3O“, protože se jedná o iont vytvořený, když se H+ kombinuje s vodou. Dalším běžným způsobem, jak odkazovat na hydroniové ionty, je jen nazývat je “ protony.“Toto jméno pochází ze skutečnosti, že H + představuje atom vodíku (jeden proton a jeden elektron), který ztratil svůj elektron a zanechal pouze holý proton.
kyselina Brnsted-Lowry je definována jako sloučenina, která dává hydroniové ionty jiné sloučenině?například kyselina chlorovodíková dává ionty H + sloučeninám, se kterými reaguje. Brnsted-Lowry báze jsou sloučeniny, které mohou přijímat hydroniové ionty?když amoniak získá hydroniový iont z HCl, tvoří amonný iont.
následující rovnice představuje reakce Brnsted-Lowryho kyseliny s Brnsted-Lowryho báze:
- HNO3 + NH3 ? NO3 – + NH4 +
při této reakci se kyselina dusičná chová jako kyselina, protože dává proton amoniaku. Amoniak se chová jako báze, protože přijímá proton z kyseliny dusičné.
pokud se však podíváte na druhou stranu rovnice, najdeme dusičnanové a amonné ionty. Protože dusičnanového iontu může přijmout protony z amonný ion (tvoří HNO3), dusičnanového iontu je velmi slabý Brnsted-Lowryho báze. Protože amonný iont má další proton, který může darovat (v tomto případě dusičnanovému iontu), je to kyselina Brnsted-Lowry.
dusičnanový iont je založen na molekule kyseliny dusičné, takže říkáme, že je to konjugovaná báze kyseliny dusičné. Podobně amonný iont je konjugovaná kyselina amoniaku. Společně se kyselina s konjugovanou bází (jako je HNO3 a NO3-) nebo báze s konjugovanou kyselinou (jako je NH3 a NH4+) označuje jako pár konjugovaných kyselin a bází.
Lewis Kyseliny a zásady
V Brnsted-Lowryho definice kyseliny a báze, báze je definována jako sloučeniny, které mohou přijímat proton. Jak však přijímá proton?
jednou z vlastností, kterou mají brnsted-Lowry báze společné, je to, že mají nesdílený pár elektronů. Když přijde hydroniový iont putující molekulou, někdy osamělé páry natáhnou ruku a popadnou ji. Příkladem je amoniak, když přijímá proton v kyselém roztoku:
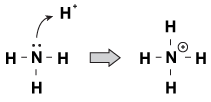
obrázek 23.1 amoniak může zachytit proton z kyseliny dusičné se svým osamělým párem elektronů.
jedním ze způsobů pohledu na tento proces je, že atom amoniaku daruje svůj osamělý pár protonu. Protože osamělé páry řídí tuto chemickou reakci, máme novou definici kyselosti a zásaditosti, nazvanou „Lewisova kyselost/zásaditost.“Lewisova báze je sloučenina, která daruje elektronový pár jiné sloučenině (amoniak v našem příkladu). Lewisova kyselina je sloučenina, která přijímá elektronový pár (h + ion v našem příkladu).
Lewis základny jsou chemické látky, které mohou darovat elektronové páry. Lewisovy kyseliny jsou chemikálie, které je mohou přijmout.
ačkoli jsme v našem příkladu měli amoniak darující osamělý pár protonu, osamělý pár v amoniaku může reagovat také s mnoha dalšími sloučeninami. Například, amoniak může darovat svůj osamělý párů elektronů na BH3 podle následujícího postupu:

Obrázek 23.2 osamělý pár na amoniak připojení se k BH3.
v tomto procesu je amoniak Lewisovou bází a BH3 Lewisovou kyselinou.
obecně je Lewisova definice kyselin a Zásad nejužitečnější, protože je nejkomplexnější ze tří definic. Například, Brnsted-Lowryho definice kyseliny obsahuje HF, ale ne BH3, který nechce ztratit proton při upevnění na osamělé páry na Lewis základnu.
výňatek z The Complete Idiot ‚ s Guide to Chemistry 2003 od Iana Gucha. Všechna práva vyhrazena, včetně práva na reprodukci zcela nebo zčásti v jakékoli formě. Používá se po dohodě s Alpha Books, členem Penguin Group (USA) Inc.
Chcete-li objednat tuto knihu přímo od vydavatele, navštivte webové stránky Penguin USA nebo volejte 1-800-253-6476. Tuto knihu si můžete také zakoupit na adrese Amazon.com a Barnes & Noble.
Leave a Reply