Chemická vazba
chemické vazby jsou zajímavosti mezi atomy, které je drží pohromadě za vzniku sloučenin. Existují tři hlavní typy vazeb: kovalentní vazby, které spojují molekulární sloučeniny, iontové vazby, které se vážou soli a iontové krystaly a kovové vazby, které se vážou atomy kovů.
molekuly a kovalentní vazby
většina paliv, plastů a přírodních produktů jsou molekulární sloučeniny vyrobené z atomů vázaných dohromady na molekuly. Typ vazby spojující atomy molekuly je kovalentní vazba, ke které dochází, když jsou mezi nimi sdíleny vnější elektrony dvou atomů, což vytváří přitažlivost mezi těmito dvěma atomy.
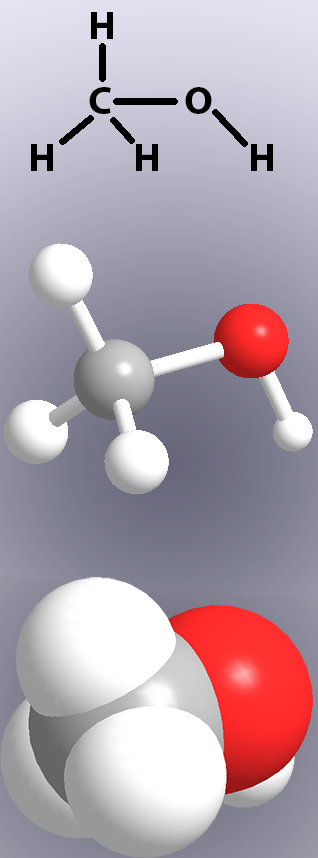
Kovalentní vazby jsou uvedeny v chemických struktur linky (Obrázek 1, nahoře) a v modelech buď představení „lepí“ nebo překrytí atomů (Obrázek 1, střední a dolní).
elektrony v kovalentní vazbě nejsou vždy sdíleny rovnoměrně mezi dvěma atomy. Pokud je sdílení nerovnoměrné, jeden atom bude mít velmi mírný kladný náboj a druhý atom bude mírně záporný. Jedná se o malý elektrický dipól-molekuly, které obsahují dipól, jsou polární sloučeniny. Zda je molekula polární nebo nepolární, ovlivní její vlastnosti, jako jsou teploty tání a varu a vodíková vazba.
Přečtěte si více o kovalentní vazbě na Chemistry LibreText.
Iontové a Kovové Lepení
Zatímco kovalentní vazby zahrnuje sdílení elektronů mezi dvěma atomy, iontové vazby zahrnuje kompletní přenos elektronů z jednoho atomu do druhého, vytváří pozitivní a negativní ionty. Tyto ionty jsou pak drženy pohromadě přitažlivostí mezi jejich opačnými náboji. Iontové sloučeniny tvoří krystaly založené na těchto atrakcích.
kovová vazba zahrnuje úplné sdílení valenčních elektronů atomů kovů a vytváří „elektronové moře“, ve kterém se elektrony mohou volně pohybovat. To je jedním z důvodů vysoké vodivosti kovů. Přečtěte si více o kovové lepení na Chemii LibreText
Energie a Chemické Vazby
Obecně platí, že energie se uvolní, když pouto formy mezi dvěma atomy, bez ohledu na to, jaký typ dluhopisů. Podobně, pokud již existuje vazba mezi dvěma atomy, bude k jejímu rozbití zapotřebí energie. Množství energie potřebné k přerušení vazby je stejné jako množství energie uvolněné, když se tvoří.
většina chemických reakcí zahrnuje jak lámání, tak vytváření chemických vazeb. Pokud je energie uvolněná vytvářením nových vazeb větší než energie potřebná k rozbití“ starých “ vazeb, bude energie uvolněna celkově reakcí. Tato energie může být ztracena jako teplo nebo může být použita k napájení.
například spalování metanu (CH4) následuje po této chemické reakci:
tato reakce zahrnuje rozbití čtyř vazeb uhlík-vodík v metanu a vazby kyslík-kyslík v O2. Nové vytvořené vazby jsou dvě vazby uhlík-kyslík (v CO2) a vazby vodík-kyslík (v H2O). Tyto nové vazby mají celkově méně energie než původní vazby, takže energie bude uvolněna touto reakcí. Uvolňování energie je charakteristickým znakem spalovacích reakcí-možná jste si toho všimli při pocitu horkého plamene. Níže uvedená animace ilustruje uhlovodíkové spalování metanu.
protože se při tvorbě CO2 a H2O při spalování uhlovodíků, jako je metan, uvolňuje velké množství energie, jedná se o dobrý zdroj primární energie. To také znamená, že by bylo zapotřebí velké množství energie k rozbití vazeb v CO2 a vytvoření dalších molekul. To je jeden z důvodů, proč fotosyntéza vyžaduje tolik energie (ze slunečního světla) k přeměně CO2 na sacharidy.
Další informace
- Chemická Energie
- Spalovací
- Primární energie
- Energetické technologie konverze
- Nebo si prohlédnout náhodné stránce
Leave a Reply