Biologie pro Obory
Výsledky Učení
- Určení prvků jednoduché chemické reakce
Všechny prvky jsou nejvíce stabilní, když jejich nejvzdálenější vrstva je naplněn elektrony podle octet pravidlo. Je to proto, že je energeticky příznivé, aby atomy byly v této konfiguraci, a to je činí stabilními. Nicméně, protože ne všechny prvky mají dostatek elektronů, aby naplnit své vnější skořápky, atomy, tvoří chemické vazby s jinými atomy, čímž se získá elektrony, které potřebují k dosažení stabilní elektronové konfigurace. Když se dva nebo více atomů chemicky spojí, výsledná chemická struktura je molekula. Známá molekula vody, H2O, se skládá ze dvou atomů vodíku a jednoho atomu kyslíku; tyto vazby dohromady tvoří vodu, jak je znázorněno na obrázku 1. Atomy mohou tvořit molekuly darováním, přijímáním nebo sdílením elektronů, aby vyplnily své vnější skořápky.
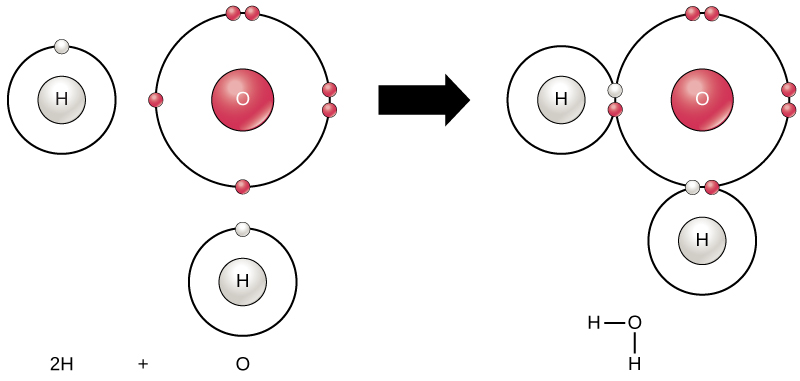
Obrázek 1. Dva nebo více atomů se mohou navzájem spojit a vytvořit molekulu. Když dva vodíky a kyslík sdílejí elektrony kovalentními vazbami, vytvoří se molekula vody.
k chemickým reakcím dochází, když se dva nebo více atomů spojí dohromady za vzniku molekul nebo když se vázané atomy rozpadnou. Látky používané v začátku chemické reakce, se nazývají reaktanty (obvykle nachází na levé straně chemické rovnice), a látky, které se nacházejí na konci reakce jsou známé jako výrobky (obvykle se nachází na pravé straně chemické rovnice). Mezi reaktanty a produkty je obvykle nakreslena šipka, která označuje směr chemické reakce; tento směr není vždy „jednosměrnou ulicí“.“Pro vytvoření molekuly vody uvedené výše by chemická rovnice byla:
2H + O → H2O
příklad jednoduché chemické reakce je rozpad peroxidu vodíku molekuly, z nichž každá se skládá ze dvou atomů vodíku vázané dva atomy kyslíku (H2O2). Reaktant peroxid vodíku je rozbité dolů do vody, obsahující jeden atom kyslíku vázány dva atomy vodíku (H2O) a kyslík, který se skládá ze dvou vázaných atomů kyslíku (O2). V následující rovnici zahrnuje reakce dvě molekuly peroxidu vodíku a dvě molekuly vody. Toto je příklad vyvážené chemické rovnice, kde počet atomů každého prvku je na každé straně rovnice stejný. Podle zákona o zachování hmoty, počet atomů před a po chemické reakci by měla být stejná, jako, že žádné atomy jsou za normálních okolností, vytvořena nebo zničena.
2H2O2 (peroxid vodíku) → 2H2O(voda) + O2 (kyslík)
I když všechny reaktanty a produkty této reakce jsou molekuly, (každý atom zůstává vázán na nejméně jeden další atom), v této reakci pouze peroxid vodíku a voda jsou zástupce podtřídy molekuly známé jako sloučeniny: obsahují atomů více než jeden typ prvku. Molekulární kyslík, na druhé straně, jak je znázorněno na obrázku 2, sestává ze dvou dvojitě vázaných atomů kyslíku a není klasifikován jako sloučenina, ale jako prvek.
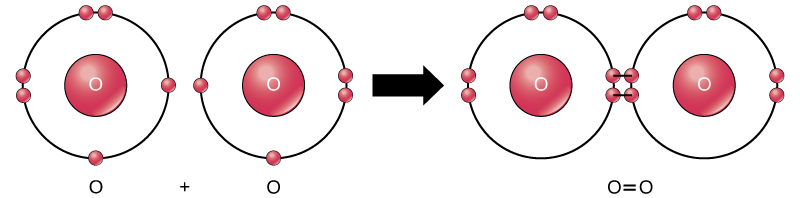
Obrázek 2. Atomy kyslíku v molekule O2 jsou spojeny dvojnou vazbou.
některé chemické reakce, jako je výše uvedená, mohou pokračovat v jednom směru, dokud se všechny reaktanty nevyčerpají. Rovnice, které popisují tyto reakce, obsahují jednosměrnou šipku a jsou nevratné. Reverzibilní reakce jsou ty, které mohou jít v obou směrech. V reverzibilní reakce, reaktanty přemění na produkty, ale při koncentraci výrobku přesahuje určitou hranici (charakteristika konkrétní reakce), některé z těchto produktů bude převeden zpět na reaktanty; v tomto bodě, označení produktů a reaktantů jsou obrácené. Toto tam a zpět pokračuje, dokud nenastane určitá relativní rovnováha mezi reaktanty a produkty-stav nazývaný rovnováha. Tyto situace reverzibilní reakce jsou často označeny chemické rovnice s dvojitou šipku směřující oba reaktanty a produkty.
například v lidské krvi se přebytečné vodíkové ionty (H+) vážou na hydrogenuhličitanové ionty (HCO3–), které tvoří rovnovážný stav s kyselinou uhličitou (H2CO3). Pokud by do tohoto systému byla přidána kyselina uhličitá, část by byla přeměněna na hydrogenuhličitanové a vodíkové ionty.
HCO3– + H+ ↔ H2CO3
V biologických reakcí, nicméně, rovnováha je velice vzácné, protože koncentrace reaktantů nebo produktů nebo obojí se neustále mění, často se produkt jedné reakce je reaktant pro druhou. Pro návrat k příkladu přebytečných vodíkových iontů v krvi bude hlavním směrem reakce tvorba kyseliny uhličité. Nicméně, kyselina uhličitá může také opustit tělo jako oxid uhličitý (přes výdechu), místo aby byly převedeny zpět do hydrogenuhličitanu iontů, tedy řízení reakce na pravdu tím, chemický zákon, známý jako zákon masové akce. Tyto reakce jsou důležité pro udržení homeostázy naší krve.
HCO3 – + H + H2 H2CO3 CO2 CO2 + H2O
v souhrnu: Chemické reakce a molekuly
vnější obal elektronů určuje, jak snadno a jaký typ chemických vazeb konkrétní atom vytvoří. Tvorba sloučenin je často vizuálně nastíněna v chemických rovnicích, které ukazují reaktanty účastnící se chemických reakcí za vzniku produktů.
zkuste to
Přispějte!
Vylepšete tuto stránkuučit se více
Leave a Reply