9.4: Iontové vazby
Energetice Iontová Vazba Formace
Iontové vazby jsou tvořeny, když pozitivně a negativně nabité ionty jsou drženy pohromadě pomocí elektrostatické síly. Zvažte jeden pár iontů, jeden kation a jeden anion. Jak silná bude síla jejich přitažlivosti? Podle Coulombův Zákon, energie elektrostatické přitažlivosti (\(E\)) mezi dvě nabité částice je úměrná velikosti náboje a nepřímo úměrná internuclear vzdálenost mezi částicemi (\(r\)):
\
\
kde každý iont je náboj je reprezentován symbolem Q konstantou úměrnosti k je rovno 2.31 × 10-28 J·m. Tato hodnota k obsahuje náboj elektronu (1.6022 × 10-19 C) pro každý iont. Rovnici lze také zapsat pomocí náboje každého iontu, vyjádřeného v coulombech (C), začleněném do konstanty. V tomto případě se konstanta proporcionality, k, rovná 8,999 × 109 J * m / C2. V uvedeném příkladu Q1 = +1 (1,6022 × 10-19 C) a Q2 = -1(1,6022 × 10-19 C). Pokud Q1 a Q2 mají opačné znaky (jako v NaCl, například tam, kde Q1 je +1 pro Na+ a Q2 je -1 pro Cl−), pak E je negativní, což znamená, že energie se uvolní, když opačně nabité ionty jsou dohromady z nekonečné vzdálenosti tvořit izolované iontové páry.
energie se vždy uvolní, když se vytvoří vazba a odpovídajícím způsobem vždy vyžaduje energii k přerušení vazby.
Jak ukazuje zelená křivka v dolní polovině Obrázku \(\PageIndex{1}\), maximální energie by být propuštěn, když ionty jsou nekonečně blízko k sobě, při r = 0. Protože ionty zabírají prostor a mají strukturu s pozitivním jádrem obklopeným elektrony, nemohou být nekonečně blízko sebe. Na velmi krátké vzdálenosti, odpudivé elektron–elektronové interakce mezi elektrony sousedních iontů silnější než přitažlivé interakce mezi ionty s opačným poplatky, jak ukazuje červená křivka v horní polovině Obrázku \(\PageIndex{1}\). Celková energie systému je rovnováha mezi atraktivními a odpudivými interakcemi. Fialová křivka na Obrázku \(\PageIndex{1}\) ukazuje, že celková energie systému se dosáhne minimální v r0, místo, kde elektrostatické repulsions a atrakce jsou přesně vyvážené. Tato vzdálenost je stejná jako experimentálně měřená vzdálenost vazby.
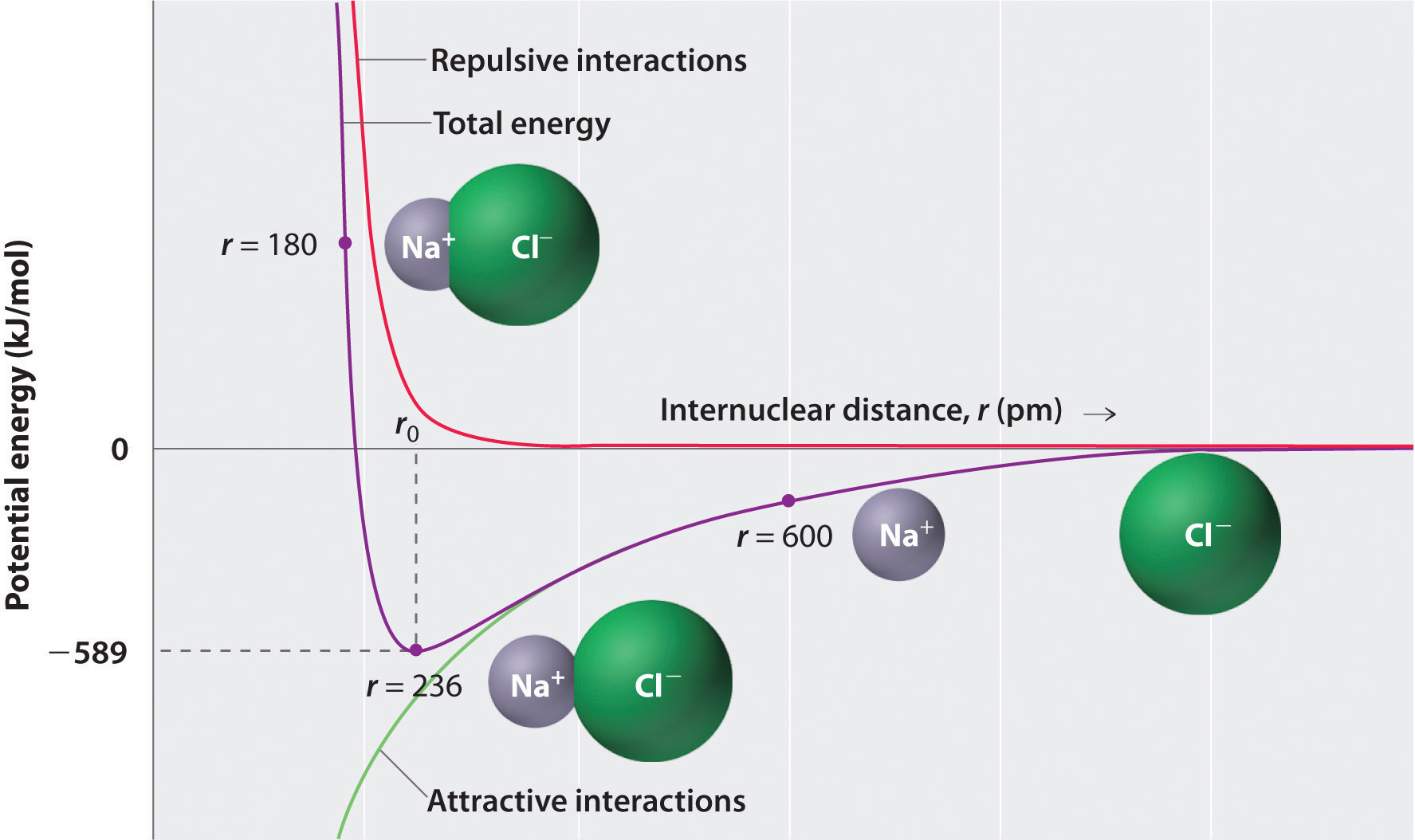
zvažte energii uvolněnou, když se plynný \(Na^+\) iont a plynný \(Cl^-\) iont spojí z r = ∞ na r = r0. Vzhledem k tomu, že pozorované plynu-fáze internuclear je vzdálenost 236 pm, energetické změny spojené s tvorbou ion-pair z \(N^+_{(g)}\) iontové a \(Cl^-_{(g)}\) ion je následující:
\ &= (2.31 \times {10^{ – 28}}\rm{J}\cdot \zrušit{m} ) \left( \dfrac{( + 1)( – 1)}{236\; \zrušit{pm} \times 10^{ – 12} \zrušit{m/hodin}} \right) \\ &= – 9.79 \ krát 10^ {- 19}\; J / ion\; pair \ label{Eq2} \end{align*}\]
záporná hodnota označuje uvolnění energie. Naše konvence je, že pokud chemický proces poskytuje energii vnějšímu světu, změna energie je negativní. Pokud to vyžaduje energii, změna energie je pozitivní. Pro výpočet změny energie při tvorbě molu párů NaCl musíme vynásobit energii na pár iontů Avogadrovým číslem:
\
Toto je energie uvolněna, když 1 mol plynného iontových párů je tvořen, ne, když 1 mol pozitivní a negativní ionty, kondenzuje a tvoří krystalické mřížky. Vzhledem k interakcím s dlouhým dosahem v mřížkové struktuře tato energie přímo neodpovídá mřížkové energii krystalické pevné látky. Velká záporná hodnota však naznačuje, že spojení kladných a záporných iontů je energeticky velmi příznivé, ať už se vytvoří iontový pár nebo krystalická mřížka.
shrnujeme důležité body o iontové vazbě:
- při r0 jsou ionty stabilnější (mají nižší potenciální energii) než v nekonečné mezijaderné vzdálenosti. Když jsou opačně nabité ionty spojeny z r = ∞ na r = r0, energie systému je snížena (energie je uvolněna).
- vzhledem k nízké potenciální energii při r0 musí být do systému přidána energie, aby se ionty oddělily. Množství potřebné energie je energie vazby.
- energie systému dosahuje minima v určité mezijaderné vzdálenosti(vzdálenost vazby).
příklad \(\PageIndex{2}\): LiF
Vypočítejte množství uvolněné energie, když se z oddělených iontů vytvoří 1 mol plynných párů li+f− iontů. Pozorovaná internukleární Vzdálenost v plynné fázi je 156 pm.
Vzhledem k tomu,: kation a anion, množství, a internuclear vzdálenost
Žádal: energie uvolněná od vzniku plynných iontů páry
Strategie:
Nahradit příslušné hodnoty do Rovnice \(\ref{Eq1b}\) pro získání energie uvolněná při vzniku jednoho iontového páru a pak vynásobte tuto hodnotu avogadrova konstanta k získání energie vydala na mol.
řešení:
Vložení hodnoty pro Li+F− do Rovnice \(\ref{Eq1b}\) (kde Q1 = +1, Q2 = -1 a r = 156 pm), zjistíme, že energie spojená s tvorbou jednoho páru Li+F− ionty,
\ &=\left(2.31 \times 10^{-28} J⋅\zrušit{m} \right) \left(\dfrac{\text{(+1)(-1)}}{156\; pm \times 10^{-12} \zrušit{m/hodin}} \right)\\ &=-1.48 \times 10^{-18} \end{align*}\]
Pak energie uvolněná na mol Li+F− iontové páry je
\ &-891 \;kJ/mol \end{align*}\]
Vzhledem k tomu, Li+ a F− jsou menší než Na+ a Cl− (viz Bod 7.3), internuclear vzdálenost v LiF je kratší než v NaCl. V důsledku toho, v souladu s Rovnicí \(\ref{Eq1b}\), mnohem více energie se uvolní, když 1 mol plynného Li+F− iontové páry je tvořen (-891 kJ/mol) než, když 1 mol plynného Na+Cl− ion páry je tvořen (-589 kJ/mol).
Cvičení \(\PageIndex{2}\): oxid Hořečnatý,
Vypočítat množství energie uvolní, když 1 mol plynného \(\ce{MgO}\) iontové páry je tvořen z oddělené ionty. Mezijaderná Vzdálenost v plynné fázi je 175 pm.
odpověď
-3180 kJ / mol = -3.18 × 103 kJ / mol
Leave a Reply